Сосуды растений — Справочник химика 21
Биохимические исследования последних лет показали, что роль элементов минерального питания растений, и особенно микро- и ультрамикроэлемеитов, определяется тем, что они входят в состав органических соединений, играюи. их важную роль в обмене веществ — хелатов. Это — органические внутрикомп-лексиые соединения циклического строения, содержащие в своей молекуле ион какого-либо металла, который непосредственно участвует в образовании кольца. Развитие учения о хелатах значительно расширяет наши представления о физиологической (ЮЛИ элементов минерального питания, и в частности металлов. Образование хелатов обеспечивает передвижение металлов по сосудам растений, перенос электронов между каталитически активными белками и т. д. [c.297]В несколько стеклянных банок налейте воды и подкрасьте ее несколькими каплями чернил. Стебли или ветки разных растений срежьте острым ножом (предпочтительнее под водой) и поставьте в банки.

Из этого опыта не следует делать вывод, что обратные эмульсии плохо перемещаются по сосудам растения. Проблема, повидимому, заключается в том, чтобы нанести на растение подходящее количество химиката, не уничтожая клетки сосудистой ткани, участвующие в его перемещении. [c.163]
Ход работы. Выращенные в теплицах в небольших сосудах растения огурца в фазе двух семядольных листьев опрыскивают рабочим составом (500 мг действующего вещества в 1 мл) из расчета 5 мл на 1 сосуд. После высыхания растения заражают колониями гриба, стряхивая конидий с сильно зараженных листьев- После этого растения инкубируют в тепличной камере в течение 7 дней. [c. 154]
154]
Для растения осмотическое давление играет огромную роль. Оно поддерживает устойчивость тканей, создавая в клетках тургор, т. е. набухание. При отмирании протоплазмы клеток последние теряют свои полупроницаемые свойства и свободно пропускают в обе стороны не только воду, но и раствор тургор прекращается и растение теряет свою эластичность (вянет). Гистологам хорошо известно, что только после того как клетка убита (фиксирована), удается окрасить ее содержимое погружением ее в раствор красок. Живая клетка, поглощая воду, задерживает большинство растворенных в ней красок. То же осмотическое давление обусловливает движение жидкостей по сосудам растения от корней и т, д. [c.237]
Крахмал синтезируется при помощи хлорофилла в зеленых листьях растений из углекислоты воздуха и воды, поступающей в листья из земли через корни растений. Этот синтез требует затраты тепла и происходит за счет световой солнечной энергии, улавливаемой листьями растений. Крахмал не остается в местах первоначального образования. Под действием энзим он постепенно распадается на низкомолекулярные сахаристые соединения, вплоть до мальтозы, которые частью потребляются на постройку новых клеток, а частью переносятся по сосудам растений в семена, корни, клубни и стволы растений, где из мальтозы снова синтезируется крахмал и отлагается в виде зерен в качестве запасного материала, необходимого для прорастания семян и клубней и вообще для развития растений в начале вегетационного периода в следующем году. [c.116]
Этот синтез требует затраты тепла и происходит за счет световой солнечной энергии, улавливаемой листьями растений. Крахмал не остается в местах первоначального образования. Под действием энзим он постепенно распадается на низкомолекулярные сахаристые соединения, вплоть до мальтозы, которые частью потребляются на постройку новых клеток, а частью переносятся по сосудам растений в семена, корни, клубни и стволы растений, где из мальтозы снова синтезируется крахмал и отлагается в виде зерен в качестве запасного материала, необходимого для прорастания семян и клубней и вообще для развития растений в начале вегетационного периода в следующем году. [c.116]
Растения в этом опыте развивались совершенно нормально, хорошо раскустились и имели интенсивную зеленую окраску. Через 30 дней после появления всходов сосуды с подопытными растениями были разбиты на две группы в первой группе растениям была дана азотная подкормка в виде сульфата аммония с пятикратным обогащением тяжелым изотопом азота Доза азота при подкормке была установлена 0,25 г на сосуд.
 Растения во второй группе сосудов были оставлены без азотной подкормки (контрольные варианты). Через 24 часа после [c.159]
Растения во второй группе сосудов были оставлены без азотной подкормки (контрольные варианты). Через 24 часа после [c.159] Как количественный метод измерения активности радиография не можег соперничать со счетчиками частиц или ионизационными камерами, но она имеет перед ними не заменимые для многих задач преимущества. При помощи радиографии можно получить на одном снимке всю картину распределения меченых веществ в препарате и находить их локализацию в мельчайших структурных единицах, в клетках и сосудах растений, в гистологических срезах, металлографических шлифах и др. Возможность длительной
X е л а т ы — это органические внутрикомплексные соединения циклического строения, в молекуле которых содержится ион какого-либо металла, принимающий участие в создании кольца. Они образуются из аминокислот, нуклеиновых и органических кислот, витаминов, антибиотиков. Свойствами хе.»а-тов обладают также ферменты, хлорофиллы и другие комплексные соединения. Хелаты обеспечивают движение металлов по сосудам растений, участвуют в переносе электронов между каталитически активными белками [c.51]
Хелаты обеспечивают движение металлов по сосудам растений, участвуют в переносе электронов между каталитически активными белками [c.51]
Отдельные участки листа желтеют. В проходящем свете хорошо видна сетка потемневших жилок, сосуды черешков и стебля на разрезе черные. Рано заболевшие растения имеют угнетенный вид, листья развиваются неравномерно, односторонне, кочан не образуется. Бактерии проникают в сосуды растения через водяные поры по края лпстьев, а также через раны на корнях и стебле. Болезнь передается с семенами. Бактерии могут сохраняться также в зараженных растительных остатках в почве до их разложения. Сильно развивается бактериоз вэ влажную теплую погоду. Устойчивые сорта капусты Савин-ская 42, Белорусская 455, Ликуришка, Завадовская 257. [c.161]
Бактерии — возбудители болезни — передаются с семенами. Проникая через поранения в сосуды растения, они разрушают их, в результате сначала увядают отдельные листья, затем побеги и, наконец, все растение. Для бактериального рака характерно увядание долек листа сначала по одной стороне. При надрезе такого листа у основания черешка обнаруживается поражение сосудов стебля и черешка. В результате разрушения внутренних тканей появляются разрывы в виде продольных трещин. Этими признаками бактериальный рак отличается от фузариозного и вертициллезного увядания, вызываемого грибами. Из стебля бактерии проникают в плоды, вызывая внутреннее поражение, которое можно обнаружить при разрезе плода тяжи сосудов, идущие к семенным камерам, окрашены в желтый цвет. Как результат наружного внешнего заражения, на плодах развивается пятнистость птичий глаз — белые пятна (у красных плодов — желтые) с темными трещинами в центре, окруженные светлым ореолом, обычно группами, ближе к плодоножке. Бактерии могут перезимовывать в растительных остатках, но в почве сохраняются короткое время.
Для бактериального рака характерно увядание долек листа сначала по одной стороне. При надрезе такого листа у основания черешка обнаруживается поражение сосудов стебля и черешка. В результате разрушения внутренних тканей появляются разрывы в виде продольных трещин. Этими признаками бактериальный рак отличается от фузариозного и вертициллезного увядания, вызываемого грибами. Из стебля бактерии проникают в плоды, вызывая внутреннее поражение, которое можно обнаружить при разрезе плода тяжи сосудов, идущие к семенным камерам, окрашены в желтый цвет. Как результат наружного внешнего заражения, на плодах развивается пятнистость птичий глаз — белые пятна (у красных плодов — желтые) с темными трещинами в центре, окруженные светлым ореолом, обычно группами, ближе к плодоножке. Бактерии могут перезимовывать в растительных остатках, но в почве сохраняются короткое время.
Мильбекс — акарицид контактного действия, эффек-гивен против всех стадий растительноядных клещей, особенно устойчивых к фосфорорганическим препаратам.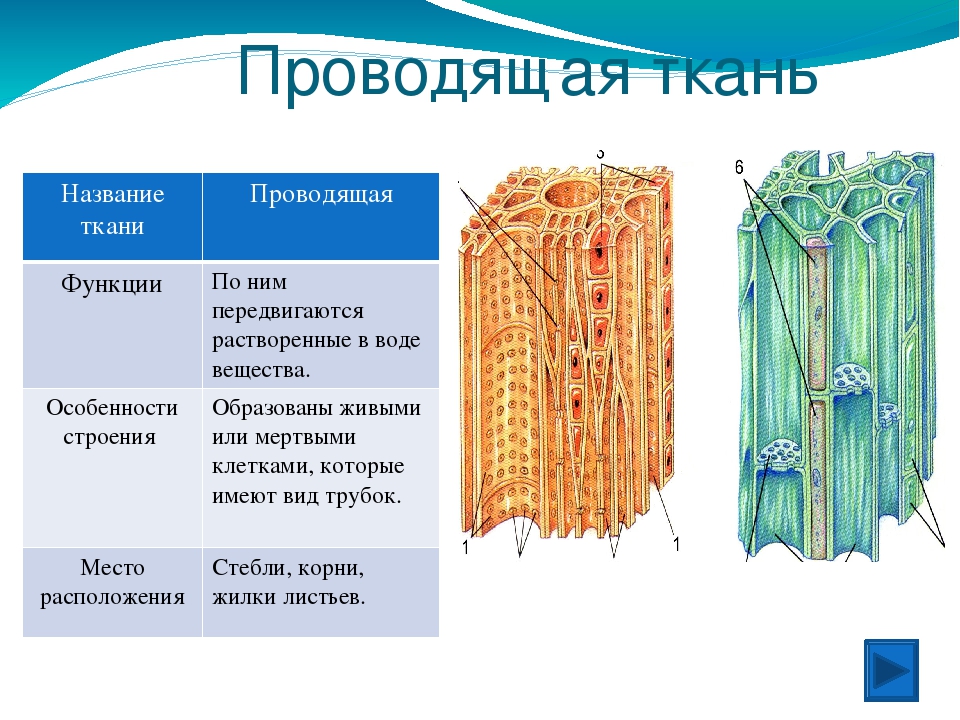
Урок-исследование «Влияние пищевого красителя на окраску цветка Бальзамина «
Влияние пищевого красителя на окраску цветка Бальзамина
Введение
Из курса биологии мы знаем, что возникновение тканей связано в истории Земли с выходом растений на сушу. Когда часть растения оказалась в воздушной среде, а другая часть (корневая) — в почве, появилась необходимость доставки воды и минеральных солей от корней к листьям, а органических веществ от листьев к корням.
Гипотеза – вода, окрашенная красителем, будет окрашивать листья и цветы растения в соответствующий красителю цвет.
Цель – экспериментально доказать правильность выдвинутой гипотезы или опровергнуть её.
Задачи:
ü Изучить строение и функцию проводящих сосудов растений;
ü Провести эксперимент с пищевыми красителями;
ü Выполнить микроскопическое исследование полученных в результате эксперимента образцов;
ü Обобщить результаты и сделать выводы.
Объект исследования
Предмет исследования– проводящая система растения Бальзамин (лат. Impatiens)
Impatiens)
Используемые методы– метод теоритического анализа, практическое исследование, метод практического анализа.
Значимость работызаключается в том, что если подтвердится наша гипотеза, станет возможным влиять на яркость цветения комнатных растений простым добавлением пищевого красителя, причем цвет цветов можно будет изменять по своему вкусу.
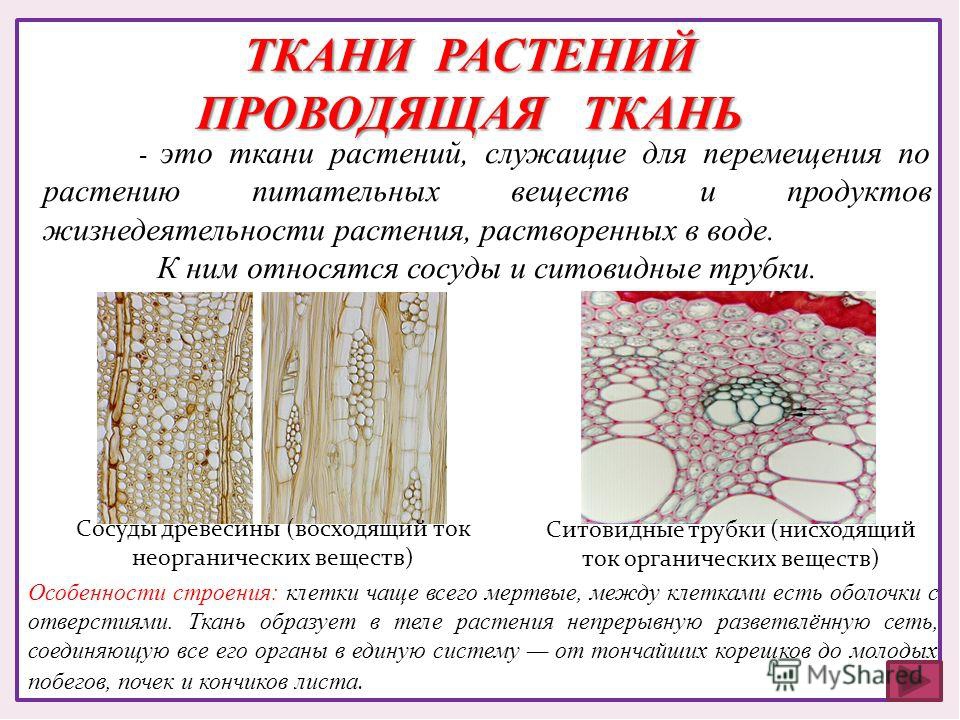
Глава 1. Проводящая ткань растений
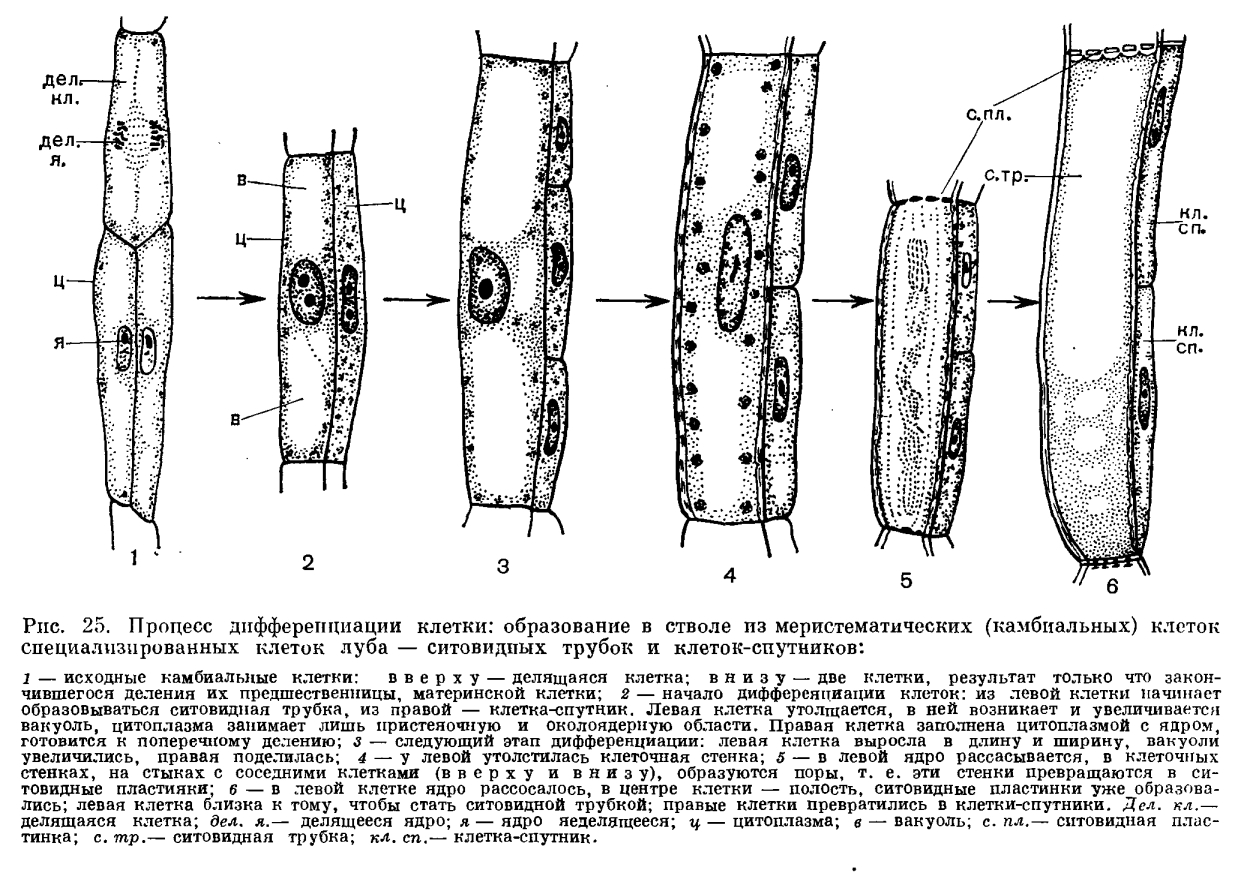
Поскольку наш краситель поступает в растение по проводящей ткани вместе с водой, то рассмотрим строение этой ткани. В растениях существует два встречных тока жидкостей, значит, проводящие ткани бывают двух родов: сосуды и трахеиды служат для проведения восходящего тока и ситовидные трубки – для проведения нисходящего тока. Сосуды, или трахеи, – это сплошные трубки, стенки которых вначале целлюлозные, а затем целиком или частично одревесневающие. Сосуды возникают из живых клеток, а позднее заполняются водой, омертвевают и в таком состоянии выполняют водопроводящую роль. Формы их разнообразны. Самые тонкие сосуды с внутренней стороны имеют утолщения в виде одревесневших колец или спиральных лент. Такие сосуды называются кольчатыми и спиральными. Более крупные сосуды – сетчатые – имеют внутренние утолщения в виде сетки, и пористые, в стенках которых расположены многочисленные простые или окаймленные поры (рис.1).
Формы их разнообразны. Самые тонкие сосуды с внутренней стороны имеют утолщения в виде одревесневших колец или спиральных лент. Такие сосуды называются кольчатыми и спиральными. Более крупные сосуды – сетчатые – имеют внутренние утолщения в виде сетки, и пористые, в стенках которых расположены многочисленные простые или окаймленные поры (рис.1).
Рис.1. Форма сосудов из проводящей ткани растений: 1 и 2 – кольчатые сосуды; 3, 4, 5 – спиральные; 6 – сетчатый; 7 – лестничный; 8 – сосуд с окаймленными порами. [1]
. Сосудисто-волокнистые пучки наиболее типичны для покрытосеменных растений. В таких пучках выделяются функционально разные части – флоэма и ксилема. Флоэма обеспечивает отток ассимилятов из листа и передвижение их в места использования или запасания. По ксилеме вода и растворенные в ней вещества передвигаются из корневой системы в лист и другие органы. Объем ксилемной части в несколько раз превосходит объем флоэмной, поскольку объем поступающей в растение воды превышает объем образуемых ассимилятов, так как значительная часть воды испаряется растением. [2]
[2]
Нас интересуют проводящие сосуды травянистых растений, поскольку мы исследуем растениеБальзамин (лат.Impatiens). Проводящие ткани в стеблях двудольных растений расположены кольцом вокруг сердцевины (Приложение. Фото 1). Проведя микроскопическое исследование стебля Бальзамина, мы убедились в этом (Приложение Фото 2). По нашей гипотезе, вода с растворенным в ней красителем должна двигаться по проводящим сосудам, окрашивая ткани вегетативной части растения.
Глава 2. Окраска цветов
От чего зависит цвет цветка? Конечно же, если растения окрашены, значит, в них есть красители – пигменты. Растительные пигменты – это крупные органические молекулы, поглощающие свет определенной длины волны. Цвет определяется способностью пигмента к поглощению света. Электромагнитные волны с длиной волны 400–700 нм составляют видимую часть солнечного излучения. Волны длиной 400–424 нм – это фиолетовый цвет, 424–491 – синий, 491–550 – зеленый, 550–585 – желтый, 585–647 – оранжевый, 647–740 нм – красный. Излучение с длиной волны меньше 400 нм – ультрафиолетовая, а с длиной волны более 740 нм – инфракрасная область спектра. Максимальное цветоразложение солнечного света приходится на 13–15 часов. Именно в это время луг, поле кажутся нам наиболее ярко и пестро расцвеченными.[3] Если свет, падающий на какую-нибудь поверхность, полностью от нее отражается, эта поверхность выглядит белой. Если все лучи поглощаются, поверхность воспринимается как черная. Если же поглощаются только лучи определенной длины, то отражение остальных создает ощущение цвета. Например, кожура апельсина поглощает лучи синей части спектра и мы видим апельсин оранжевым. [3]
Излучение с длиной волны меньше 400 нм – ультрафиолетовая, а с длиной волны более 740 нм – инфракрасная область спектра. Максимальное цветоразложение солнечного света приходится на 13–15 часов. Именно в это время луг, поле кажутся нам наиболее ярко и пестро расцвеченными.[3] Если свет, падающий на какую-нибудь поверхность, полностью от нее отражается, эта поверхность выглядит белой. Если все лучи поглощаются, поверхность воспринимается как черная. Если же поглощаются только лучи определенной длины, то отражение остальных создает ощущение цвета. Например, кожура апельсина поглощает лучи синей части спектра и мы видим апельсин оранжевым. [3]
Изменится ли окраска цветка при добавлении в воду дополнительного красителя?
Глава 3. Практическая часть
Для эксперимента мы взяли растение Бальзамин(лат.Impatiens) семейства Бальзаминовых (Balsaminaceae) (Приложение. Фото 3).Выбор растения неслучаен, так как черенки бальзамина способны быстро давать корни. Наша задача – посмотреть, какое действие оказывает на бальзамин, а конкретно на его цветы, пищевой краситель.
Наша задача – посмотреть, какое действие оказывает на бальзамин, а конкретно на его цветы, пищевой краситель.
Мы взяли краситель, который используется при приготовлении тортов – красного и синего цвета. По нашей гипотезе синий краситель должен изменить окраску цветка бальзамина в голубой цвет, а красный усилить интенсивность природной окраски цветка. Сделали концентрированный раствор красителя и разводили водой в следующих пропорциях – 1/3, 1/5, 1/7, 1/9 (Приложение. Фото 4). Поместили в приготовленный раствор черенки бальзамина (Приложение. Фото 5). Через пять дней появились корни, произошло окрашивание корней, но видимых изменений в окраске листьев не наблюдалось.
Через десять дней провели микроскопическое исследование. Исследовали лист бальзамина под микроскопом (Приложение. Фото 6). В образце № 4 с концентрацией раствора 1/9 хорошо просматривается наличие синего красителя не только в проводящем пучке, но и в клетках листа (Приложение Фото 7).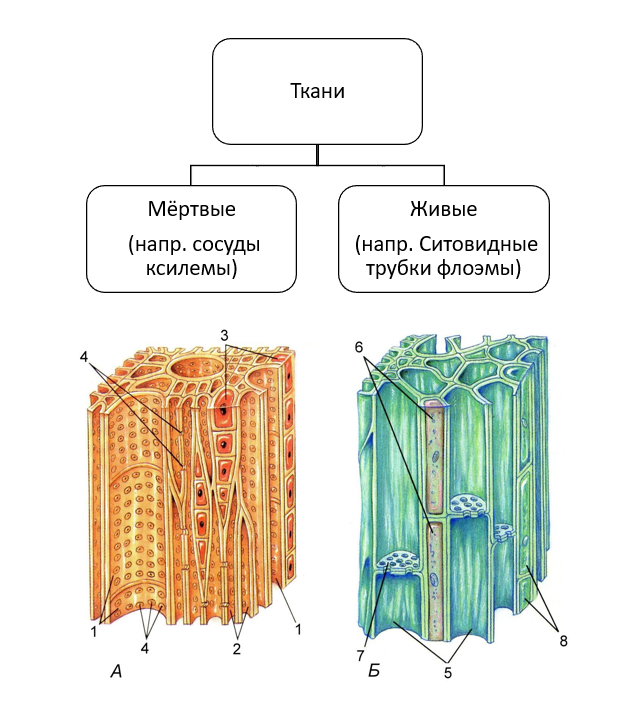 Аналогичное исследование мы провели и с образцами № 4 красный. При микроскопическом исследовании образца № 4 красный с концентрацией раствора 1/9 видно наличие красного красителя в проводящей системе стебля. Образцы № 3 получили легкое окрашивание вдоль проводящего пучка. Образцы №1, №2, как красный, так и синий, видимых изменений в окраске не получили (Приложение. Фото 9). Надо сказать, что внешне листья бальзамина не окрасились в синий цвет, но в образце № 4 синий листья стали несколько темнее, чем у контрольного образца.
Аналогичное исследование мы провели и с образцами № 4 красный. При микроскопическом исследовании образца № 4 красный с концентрацией раствора 1/9 видно наличие красного красителя в проводящей системе стебля. Образцы № 3 получили легкое окрашивание вдоль проводящего пучка. Образцы №1, №2, как красный, так и синий, видимых изменений в окраске не получили (Приложение. Фото 9). Надо сказать, что внешне листья бальзамина не окрасились в синий цвет, но в образце № 4 синий листья стали несколько темнее, чем у контрольного образца.
Через 3 недели у образца № 4 синий появились цветы. При микроскопическом исследовании цветка определили, что синий краситель проник в клетки лепестков цветка (Приложение.Фото 10).Синий краситель концентрируется по краям лепестка (приложение.Фото 11). Внешне цветок тоже приобрел слегка голубоватый оттенок.
При визуальном исследовании растений видно, что произошло окрашивание корней, стебля и, в некоторой степени, листьев. Причем заметные результаты влияние красителя на цвет растения имеют только образцы № 4. Очевидно, что концентрация красителя для получения желаемого результата должна быть высокой. Красный краситель не оказал внешне заметного влияния на окраску листьев растения.
Очевидно, что концентрация красителя для получения желаемого результата должна быть высокой. Красный краситель не оказал внешне заметного влияния на окраску листьев растения.
Результаты наблюдений мы заносили в таблицу
Синий краситель | ||||
Наблюдаемые результаты | Образец № 1 1 часть воды и 3 части раствора красителя 1/3 | Образец № 2 1 часть воды и 5 частей раствора красителя 1/5 | Образец № 3 1 часть воды и 7 частей раствора красителя 1/7 | Образец № 4 1часть воды и 9 частей раствора красителя 1/9 |
Через 5 дней. Наблюдение
| Появились корни, произошло окрашивание корней соответствующей интенсивности. Изменений в окраске листьев нет.
| |||
Через 10 дней. Наблюдение | Изменений в цвете листа нет | Изменений в цвете листа нет | Изменений в цвете листа нет | Листья стали темнее. |
Через 10 дней. Микроскопическое исследование | видимых изменений окраски не произошло | видимых изменений окраски не произошло | Слегка изменилась окраска в проводящих пучках | хорошо просматривается наличие синего красителя не только в проводящем пучке, но и в клетках листа. |
Через 21 день. Визуальное исследование цветка | Заметных изменений в цвете цветка не наблюдается | Заметных изменений в цвете цветка не наблюдается | Заметных изменений в цвете цветка не наблюдается | По краям цветка заметна синяя окраска. |
Через 21 день. Микроскопическое исследование цветка | Заметных изменений в цвете цветка не наблюдается | Заметных изменений в цвете цветка не наблюдается | Небольшая концентрация синего красителя | Синий краситель концентрируется по краям лепестка. |
Красный краситель | ||||
Наблюдаемые результаты | Образец № 1 1 часть воды и 3 части раствора красителя 1/3 | Образец № 2 1 часть воды и 5 частей раствора красителя 1/5 | Образец № 3 1 часть воды и 7 частей раствора красителя 1/7 | Образец № 4 1 часть воды и 9 частей раствора красителя 1/9 |
Через 5 дней.
| Появились корни, произошло окрашивание корней соответствующей интенсивности. Изменений в окраске листьев нет. | |||
Через 10 дней. Наблюдение | Изменений в цвете листа нет | Изменений в цвете листа нет | Изменений в цвете листа нет | Изменений в цвете листа нет |
Через 10 дней. Микроскопическое исследование | видимых изменений окраски не произошло | видимых изменений окраски не произошло | легкое окрашивание вдоль проводящего пучка | Видно наличие красного красителя в проводящей системе стебля. |
Через 21 день. Микроскопическое исследование цветка | Изменений нет | Изменений нет | Изменений нет | Изменений нет |
Заключение
Проводящие ткани являются важнейшей составной частью большинства высших растений.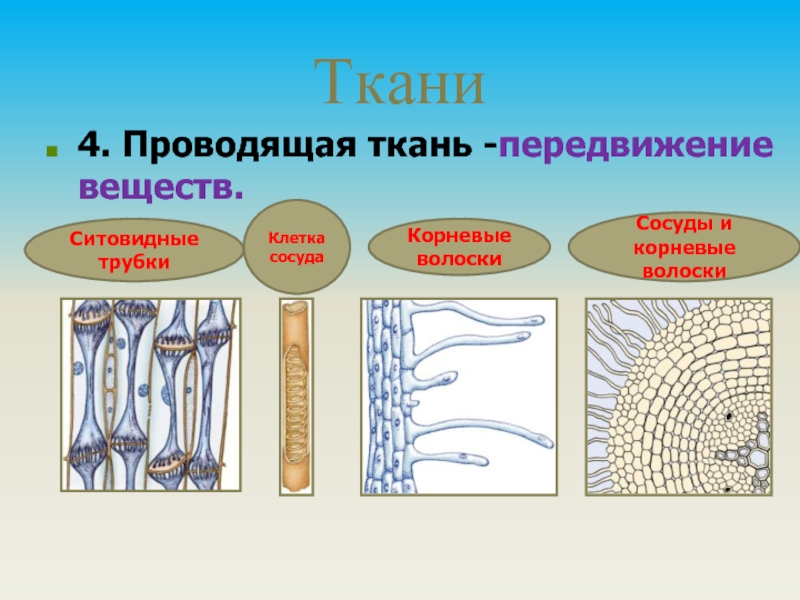 Они являются обязательным структурным компонентом вегетативных и репродуктивных органов споровых и семенных растений. Проводящие ткани в совокупности с клеточными стенками и межклетниками, некоторыми клетками основной паренхимы и специализированными передаточными клетками образуют проводящую систему, которая обеспечивает дальний и радиальный транспорт веществ. Благодаря особой конструкции клеток и их расположению в теле растений проводящая система выполняет многочисленные, но взаимосвязанные функции:
Они являются обязательным структурным компонентом вегетативных и репродуктивных органов споровых и семенных растений. Проводящие ткани в совокупности с клеточными стенками и межклетниками, некоторыми клетками основной паренхимы и специализированными передаточными клетками образуют проводящую систему, которая обеспечивает дальний и радиальный транспорт веществ. Благодаря особой конструкции клеток и их расположению в теле растений проводящая система выполняет многочисленные, но взаимосвязанные функции:
1) передвижение воды и минеральных веществ, поглощенных корнями из почвы, а также органических веществ, образуемых в корнях, в стебель, листья, репродуктивные органы;
2) передвижение продуктов фотосинтеза из зелёных частей растения в места их использования и запасания: в корни, стебли, плоды и семена;
3) передвижение фитогормонов по растению, что создает определённый их баланс, который определяет темпы роста и развития вегетативных и репродуктивных органов растений;
4) радиальный транспорт веществ из проводящих тканей в рядом расположенные живые клетки других тканей;
5) проводящие ткани повышают устойчивость органов растений к деформирующим нагрузкам;
6) проводящие ткани образуют непрерывную разветвленную систему, связывающую органы растений в единое целое. [2]
[2]
Преследуя совсем другие цели в нашей практической работе, мы невольно доказали последнее свойство проводящей ткани. Благодаря проведенному эксперименту мы подтвердили выдвинутую гипотезу – вода, окрашенная красителем, будет окрашивать листья и цветы растения в соответствующий красителю цвет. Однако, цвет красителя имеет значение. Как мы убедились, эксперимент с красным красителем не дал ожидаемых результатов. Почему? Возникает новый вопрос, требующий изучения. Есть все основания продолжить научное исследование в этом направлении.
Поставленная в работе цель выполнена —экспериментально доказано правильность выдвинутой гипотезы.
Предполагаемая значимость работы в результате проведенного эксперимента почти подтвердилась. Стало очевидно, что не все цвета красителя усиливают или изменяют цвет цветка. Есть предположение, что наличие соответствующего по цвету пигмента перебивает действие красителя. Но это тема уже другого исследования.
Но это тема уже другого исследования.
Как очистить сосуды от холестерина: список продуктов
Иностранные учёные назвали продукты, которые помогают сохранить нормальное состояние стенок сосудов и очистить их от холестериновых бляшек, сообщает Inforeactor.
Список продуктов для очистки сосудов от холестерина:
- Мясо курицы и индейки
- Лосось, шпинат, капуста, зелень, репа, бобовые
- Чеснок, гранатовый сок
- Капуста кимчи
- Куркума
- Семена кунжута
Какие продукты очищают сосуды от холестерина
Сохранить здоровье сердечно-сосудистой системы помогает пища, богатая L-аргинином. Он снижает количество жира в организме и способствует наращиванию мышечной массы.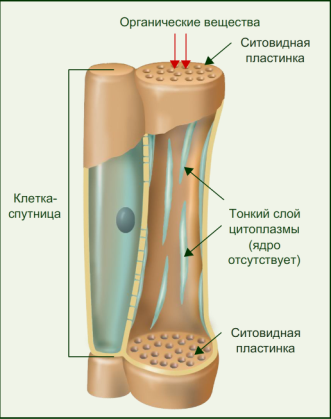 Аргинин содержится в мясе курицы и индейки.
Аргинин содержится в мясе курицы и индейки.
Также на сосуды благоприятно влияют витамины группы B, в частности, В6, В9, В12. Эти витамины в достаточном количестве есть в лососе, шпинате, капусте, зелени, репе и бобовых.
Кроме того, «прочистить» сосуды поможет чеснок и гранатовый сок. В состав чеснока входит аллицин, который, вступая в реакцию с эритроцитами, образует сероводород. Данная реакция помогает расслабить стенки кровеносных сосудов. А гранатовый сок богат антиоксидантами, которые очень эффективны в борьбе с сердечно-сосудистыми заболеваниями.
Воздействие вредных химических веществ снижает капуста кимчи, так как этот продукт содержит ферменты, способные уничтожать химические вещества, попадающие в наш организм извне.
В куркуме, по данным исследователей, содержится полезный для здоровья полифенол — куркумин, который помогает предотвратить закупорку сосудов.
Помимо этого, в рацион рекомендуется включить семена кунжута. Содержащиеся в них вещества препятствуют развитию атеросклеротических поражений.
А диетологи порекомендовали сладости, которые не вредят фигуре: фрукты, ягоды, сухофрукты, цукаты, горький шоколад и зефир.
Золотой корень – особенности и терапевтические эффекты
Многолетнее растение родиола розовая, известное также как Золотой корень, произрастает в горах Алтая, на таежном севере и в тундре. По биологической классификации относится к суккулентам – способно накаливать и сохранять влагу в наземных частях и корнях. Корневище у растения неправильной формы, мясистое, золотистого оттенка. В России родиола растет в Сибири, на берегу Белого моря, на малодоступных территориях Дальнего Востока. Растение занесено в Красную книгу. Единственное место, где разрешен сбор дикорастущих экземпляров – Алтайский край.
Состав и полезные свойства
Золотой корень – мощный естественный адаптоген, который помогает человеку справляться с повышенными физическими и психоэмоциональными нагрузками, адаптироваться к стрессовым ситуациям. Известны стимулирующие качества растения. По эффективности и силе воздействия родиолу часто сравнивают с женьшенем. Отвары и спиртовые настойки родиолы снимают усталость и активируют скрытые резервы организма.
Известны стимулирующие качества растения. По эффективности и силе воздействия родиолу часто сравнивают с женьшенем. Отвары и спиртовые настойки родиолы снимают усталость и активируют скрытые резервы организма.
Основные запасы активных соединений хранятся в корне. Чем старше корневище, тем больше полезных веществ в нем накапливается. В лечебных и профилактических целях используют экземпляры возрастом от 4 лет и более. У таких растений массивные корневища, покрытые твердым пробковым слоем золотистого оттенка. Мякоть внутри белая с розовым оттенком и терпким ароматом, напоминающим запах цветущих роз.
Науке хорошо известен состав корневища – всего в нем присутствует более 140 активных соединений, но наиболее важными признаны следующие:
- Родиолозид. Наиболее ценное соединение в составе. Содержание в корне достигает 1%. Вещество повышает иммунный статус, подавляет деятельность вирусов, патогенных бактерий и свободных радикалов.
- Флавоноиды. Естественные антиоксиданты.
 Сохраняют эластичными стенки капилляров и артерий. Нормализуют ритм сердца и давление.
Сохраняют эластичными стенки капилляров и артерий. Нормализуют ритм сердца и давление. - Танины (дубильные соединения). Подавляют активность патогенной микрофлоры, обладают заживляющим действием, нейтрализуют токсины.
- Антрахиноны. Вещества, повышающие иммунитет. Действуют, как природное слабительное.
- Кумарины. Предотвращают образование тромбов, препятствуют появлению опухолей.
- Органические кислоты. Наиболее активные из них – яблочная и щавелевая. Участвуют в биохимических процессах, стимулируют метаболизм, улучшают насыщение тканей и органов кислородом и питательными веществами.
- Эфирные масла. Снимают воспаления, снижают болевую симптоматику.
- Микроэлементы. Их в составе десятки. Оказывают комплексное оздоровительное влияние на все системы и органы.
Терапевтическое действие
Золотой корень известен во всем мире как стимулятор нервной системы, естественный и безопасный энергетик. При умеренном применении он не расходует, а восстанавливает силы организма.
Другие лечебные эффекты:
- родиола снимает воспаление, помогает при подагре и артритах различного происхождения;
- стимулирует работу сердца, защищает сосуды;
- подавляет активность раковых клеток;
- ускоряет заживление ран, в том числе внутренних;
- выводит из организма токсины;
- подавляет действие патогенных микроорганизмов – вирусов, грибков и бактерий;
- помогает при синдроме хронической усталости;
- защищает нервную систему;
- стимулирует когнитивные функции;
- снижает риск инфаркта;
- ускоряет метаболизма, применяется в качестве вспомогательного средства при похудении и диетическом питании.
Растение и лекарства на его основе используют при комплексном лечение гинекологических заболеваний. Препараты назначают при нерегулярном менструальном цикле и климаксе. Активные соединения снижают риск развития опухолей молочной железы.
Настойки, отвары и чаи помогают при авитаминозе, анемии и низком давлении, атеросклерозе, болезнях дыхательной системы, венозной недостаточности.
Растение широко используется в косметологии и индустрии красоты. Масла из родиолы используют для изготовления омолаживающих примочек, ухода за кожей в зимнее время, улучшения здоровья волос.
Противопоказания
Родиола розовая противопоказана при индивидуальной непереносимости, повышенном давлении, проблемах со сном и чрезмерной нервной возбудимости. Не желательно применять стимулирующие составы при беременности и кормления грудью.
Источник и фото: “Алтайвита” https://altaivita.ru/blog/zolotoy-koren/
На правах рекламы
Бурая бактериальная гниль – опасная карантинная болезнь / Россельхознадзор
Бурая бактериальная гниль – заболевание, широко распространенное в странах тропического и субтропического пояса, поражает преимущественно картофель и томаты, является карантинным объектом на территории России. Это чрезвычайно опасное карантинное заболевание, способное вызвать гибель всех растений.
В острой форме пораженные растения быстро без видимой причины увядают и погибают, при этом задержки роста или пожелтения листьев не наблюдается. В хронической форме первые признаки болезни обычно можно выявить во время цветения и начало формирования клубня. Растения внезапно увядают, листья желтеют, сморщиваются и повисают. В нашей стране наряду с симптомами увядания иногда наблюдаются почернение и мацерация стебля. Нижняя прикорневая часть размягчается и загнивает. На разрезе стеблей видны буровато-жёлтые кольца пораженных сосудов, заполненных слизистой массой бактерий, при сжатии стеблей коревые элементы легко отслаиваются, сердцевина разлагается, в стебле образуется полость. При поражении молодых побегов их сосуды просвечивают в виде продольных бурых полос, иногда подобные полосы видны на жилках листа.
Бактерии, обитающие в почве, способны сохраняться длительное время, они проникают в корни растений, откуда впоследствии перемешаются в стебель. При развитии болезни бактерии вызывают побурение сосудов.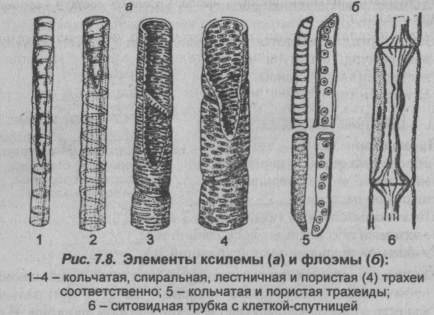 Они блокируют сосудистую систему растений, что приводит к его увяданию. Из срезов пораженных сосудов вытекает слизь — экссудат бактерий. Во влажную погоду он выделяется и из трещин пораженных стеблей, что является одним из симптомов заболевания.
Они блокируют сосудистую систему растений, что приводит к его увяданию. Из срезов пораженных сосудов вытекает слизь — экссудат бактерий. Во влажную погоду он выделяется и из трещин пораженных стеблей, что является одним из симптомов заболевания.
Клубни, пораженные бурой гнилью, как правило, имеют комочки у глазков, так как у больных клубней через глазки выделяется слизистый экссудат, к которому прилипает почва. При продольном разрезе таких клубней отмечаются блестящие капельки слизи бактерий по периметру сосудистого кольца. Цвет кольца коричневый. Наличие сверкающих капель — наиболее характерный признак бурой гнили при разрезе клубня.
Диагностика заражения сводится к микроскопическому и ферментативному тестированию. Также визуального обследования посадок картофеля во время вегетации и хранения картофеля.
Основными методом распространения болезни являются почва, использование зараженного посадочного материала, насекомые, нематоды, растительные остатки, сорные растения, поливные воды, сельскохозяйственная техника и инструменты.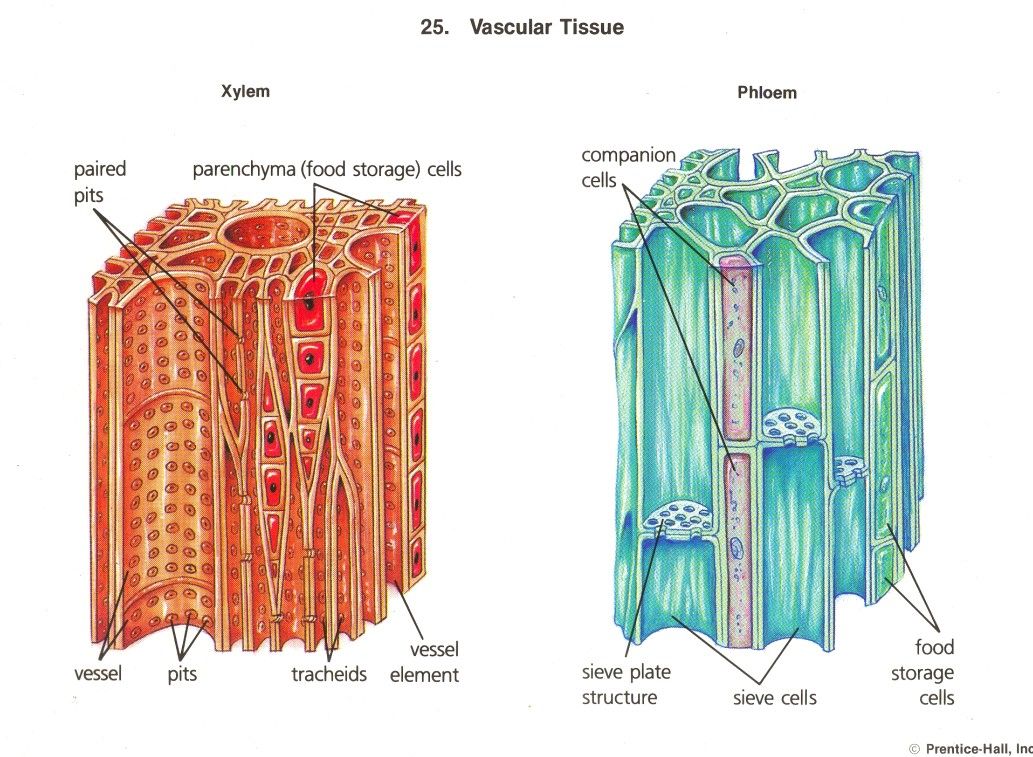
Для борьбы с бурой бактериальной гнилью необходимо соблюдение севооборотов, пользоваться проверенный семенной материал, уничтожать сорные растения, бороться с нематодами и колорадским жуком, уничтожать ботву перед уборкой, использовать устойчивые сорта, проводить протравливания перед посадкой.
При обнаружении признаков заражения бурой бактериальной гнилью необходимо известить Управление Россельхознадзора по тел. 8 (3822) 444-219, 262-224.
Источник: Управление Федеральной службы по ветеринарному и фитосанитарному надзору по Томской области
Чистка сосудов головного мозга Лекарственными Травами.
Головной мозг – важнейший орган человеческого организма, который отвечает за работу различных систем. Большинство заболеваний мозга вызывают проблемы с сосудами – наследственные, возрастные, возникающие в результате воздействия провоцирующих факторов. Главная причина проблем – нарушения в работе системы кровообращения. Головной мозг постоянно испытывает острое голодание (ему не хватает и кислорода, и питательных веществ), в результате чего начинаются процессы отмирания клеток. Чистка сосудов органа способна заметно улучшить самочувствие, продлить качество и срок жизни.
Головной мозг постоянно испытывает острое голодание (ему не хватает и кислорода, и питательных веществ), в результате чего начинаются процессы отмирания клеток. Чистка сосудов органа способна заметно улучшить самочувствие, продлить качество и срок жизни.
Для очистки сосудистых структур органа обычно прописывают лекарственные препараты – эффективные, но дорогие и не безопасные для печени.
Поэтому мы предлагаем вам рассмотреть альтернативный вариант лечения – с применением народных средств.
Травы для лечения сосудов головного мозга Рассмотрим самые популярные и эффективные способы чистки сосудов травами.
✿ Приготовьте смесь из пяти частей листьев клевера, пяти полыни, двух мирты, одной майорана и ½ семени петрушки. Данного сбора хватит надолго, для приготовления одной порции используйте на литр кипятка 3 столовых ложки. Настаивать травы нужно в течение 3 – 6 часов, а затем принимать по 1⁄4 стакана каждые 3 часа.
✿ Возьмите в равном соотношении корень лопуха, листья березы и мяты, траву сушеницы болотной, плоды шиповника, чай почечный и элеутерококк колючий. Столовую ложку смеси залейте парой стаканов крутого кипятка и дайте настояться в течение 2 часов. Принимать настой следует трижды в день по 100 мл.
✿ Берите по паре столовых ложек березовых почек, травы зверобоя, бессмертника, ромашки и залейте литром кипятка. Дайте настояться, разделите на 2 части и выпейте в 2 подхода – утром и вечером. Дополнительно в настой можно добавить чайную ложку меда и капельку эфирного масла.
✿ Столовую ложку измельченных листьев лопуха кладут в термос и заливают 0,5 л кипятка. Пить настой нужно утром по 100 мл, курс лечения составляет 3 месяца.
✿ Берите по 2 столовых ложки ягод шиповника и шелухи лука, 5 столовых ложек иголок сосны. Заливайте литром воды, ставьте на огонь, доводите до кипения и оставляйте на ночь. Суточная норма отвара – 500 мл, разделить ее желательно на несколько частей. Курс лечения 3 месяца
Курс лечения 3 месяца
Если не хочется тратить время на приготовление сложносоставных настоев, используйте однокомпонентные рецепты:
✿ Столовую ложку стальника полевого заливают стаканом кипятка, дают настояться. Принимают отвар 4 раза в день по 50 мл, курс лечения 3 месяца.
✿ Цветки граба – эффективное, хоть и редкое средство. Столовую ложку цветков заваривают стаканом кипятка и пьют в течение дня в 3 подхода. Курс лечения полтора месяца.
✿ Измельчите кофемолкой пару столовых ложек семени льна, заварите 200 мл кипятка, дайте настояться до остывания. Пейте по половине стакана перед сном в течение 4 месяцев.
Лечение сосудов травами очень эффективно. Главное регулярность и коррекция общего образа жизни – если вы будете пить настой через раз и продолжите питаться как попало, употреблять алкоголь, эффекта не будет.
Необычные цветочные горшки, вазы и сосуды для выращивания комнатных растений | Vogue
Вне зависимости от того, светит ли весеннее солнце или вдруг разыгралась снежная буря в конце марта, цветы — всегда маленькая радость. Но обычный букет живет всего несколько дней. Для ценителей прекрасного у нас есть и долгоиграющие варианты. Выращивать такие цветы можно легко и с комфортом. Список самих растений у нас получился весьма приличный, а красивых цветочных горшков, ваз и флорариумов хоть отбавляй. Наши фавориты — ниже.
Но обычный букет живет всего несколько дней. Для ценителей прекрасного у нас есть и долгоиграющие варианты. Выращивать такие цветы можно легко и с комфортом. Список самих растений у нас получился весьма приличный, а красивых цветочных горшков, ваз и флорариумов хоть отбавляй. Наши фавориты — ниже.
Среди зелени, которую можно поселить у себя, нам полюбились так называемые воздушные растения. Так, например, особенность эпифитной тилландсии (вечнозеленой травки из Америки) заключается в том, что питается она через листья, а корни необходимы ей только для того, чтобы иметь возможность держаться за деревья, поэтому это растение не нужно сажать в горшок и можно украсить им самые необычные предметы.
Не менее уютно выглядит мох — его можно выращивать отдельно или добавлять в композиции с суккулентами. В Москве у Levi Flower можно купить целые мохнариумы — композиции из камней, мха и маленьких скульптур, которые напоминают макет леса.
А вот австралийцы Pistils Nursery предлагают выращивать еще и водоросли: японское поверье гласит, что две шарообразные водоросли эгагропила линнея, живущие в одном аквариуме, дарят любовь.
10 необычных способов выращивать растения
Смотреть галерею
Наше воображение поразил художник Монти из Нью-Йорка, который создает удивительные, похожие на инопланетных существ, горшки на курьих ножках с отверстиями по бокам, из которых торчат суккуленты, некоторые — с хвостиками или пушком. И не менее интересна идея японского бренда 10¹² Terra, который предлагает наблюдать не только за цветением кактуса, но и за ростом его корней с помощью стеклянной вазы с разделением, на котором держится растение. Еще 10 идей для модного садовода ищите ниже.
10 необычных способов выращивать растения
Смотреть галерею
Подпишитесь и станьте на шаг ближе к профессионалам мира моды.
Сравнение стеклянных сосудов и пластиковых пакетов для ограждения частей живых растений для анализа свободного пространства
Агелопулос, Н. Г. и Пикетт, Дж. А. 1998. Анализ свободного пространства в химической экологии: влияние различных методов отбора проб на соотношения летучих соединений, присутствующих в пробах свободного пространства. J. Chem. Ecol. 24: 1161–1172.
J. Chem. Ecol. 24: 1161–1172.
Артикул CAS Google ученый
Агелопулос, Н.Г., Чемберлен, К.и Пикетт, Дж. А. 2000. Факторы, влияющие на выбросы летучих веществ с интактных растений картофеля, Solanum tuberosum : Изменчивость количеств и стабильность соотношений. J. Chem. Ecol. 26: 497–511.
Артикул CAS Google ученый
Андерссон, С. и Добсон, Х. Э. М. 2003. Антенные реакции на цветочные ароматы у бабочки Heliconius melpomene . J. Chem. Ecol. 29: 2319–2330.
Артикул PubMed CAS Google ученый
Azuma, H., Thien, LB, Toyota, M., Asakawa, Y., and Kawano, S. 1997. Распределение и дифференциальная экспрессия ( E ) -4,8-диметил-1,3 , 7-нонатриен в летучих компонентах листьев и цветов таксонов Magnolia и Liriodendron. J. Chem. Ecol. 23: 2467–2478.
23: 2467–2478.
Артикул CAS Google ученый
Бакман, А.К., Бенгтссон, М., Борг-Карлссон, А.К., Либликас, И. и Витцгалл, П., 2001. Летучие вещества яблони ( Malus domestica ), вызывающие антенные реакции у самок плодожорки Cydia pomonella (L.) (Lepidoptera: Tortricidae): Влияние повреждения растений и методика отбора проб. Z. Nat.forsch., C. J. Biosci. 56: 262–268.
CAS Google ученый
Бернаскони, М. Л., Терлингс, Т. К. Дж., Амброзетти, Л., Bassetti, P., and Dorn, S. 1998. Выбросы кукурузы, вызванные травоядными животными, отталкивают кукурузную тлю, Rhopalosiphum maidis . Энтомол. Exp. Прил. 87: 13–142.
Артикул Google ученый
Биркетт, М.А., Чемберлен, К., Герриери, Э., Пикетт, Дж. А., Вадхамс, Л.Дж., и Ясуда, Т. 2003. Летучие вещества из растений, зараженных белокрылкой, вызывают у паразитоидов реакцию определения местонахождения хозяина, Encarsia formosa . J. Chem. Ecol. 29: 1589–1600.
J. Chem. Ecol. 29: 1589–1600.
Артикул PubMed CAS Google ученый
Блэкмер, Дж. Л., Родригес-Саона, К., Байерс, Дж. А., Шоп, К. Л. и Смит, Дж. П. 2004. Поведенческая реакция Lygus hesperus на аналог и летучие вещества люцерны в свободном пространстве над головой в ольфактометре с Y-образной трубкой. J. Chem. Ecol. 30: 1547–1564.
Артикул PubMed CAS Google ученый
Bruin, J.и Дике, М. 2001. Передача химической информации между поврежденными и неповрежденными растениями: резервное копирование будущего. Biochem. Syst. Ecol. 29: 1103–1113.
Артикул CAS Google ученый
Чох, Ю., Шимода, Т., Одзава, Р., Дике, М., и Такабаяси, Дж. 2004. Воздействие на листья лимской фасоли летучих веществ из растений-видов, вызываемых травоядными, приводит к выбросу аттрактантов плотоядных.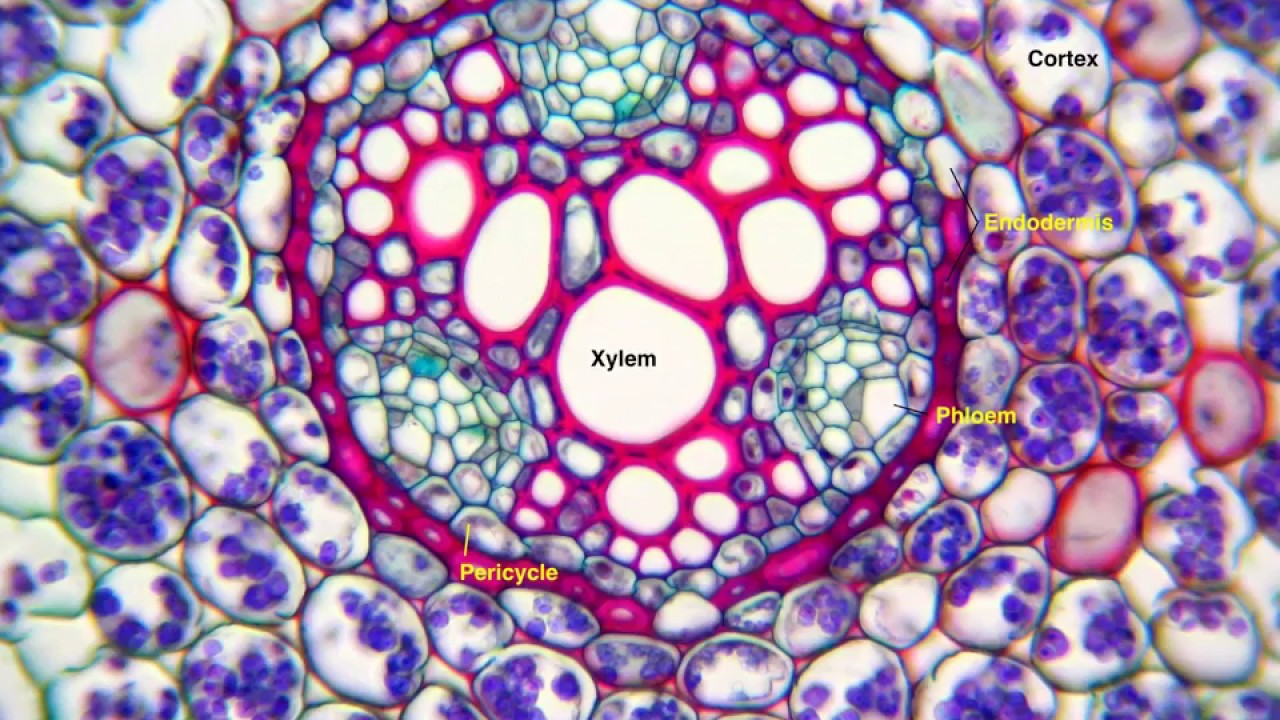 : Активный или пассивный процесс? Дж.Chem. Ecol. 30: 1305–1317.
: Активный или пассивный процесс? Дж.Chem. Ecol. 30: 1305–1317.
Артикул PubMed CAS Google ученый
Дэвис, Э. 1987. Реакции на раны у растений, стр. 243–264, в Д. Дэвис (ред.). Биохимия растений. Vol. 12, Academic Press, Лондон.
Google ученый
Демент В. А., Тайсон Б. Дж. И Муни Х. А. 1975. Механизм улетучивания монотерпена в Salvia mellifera . Фитохимия 14: 2555–2557.
Артикул CAS Google ученый
Де Бур, Дж. Г., Постумус, М. А., и Дике, М. 2004. Идентификация летучих веществ, которые используются для различения растений, зараженных хищным клещом, или травоядных животных, не являющихся жертвами. J. Chem. Ecol. 30: 2215–2230.
Артикул PubMed Google ученый
de Bruxelles, G.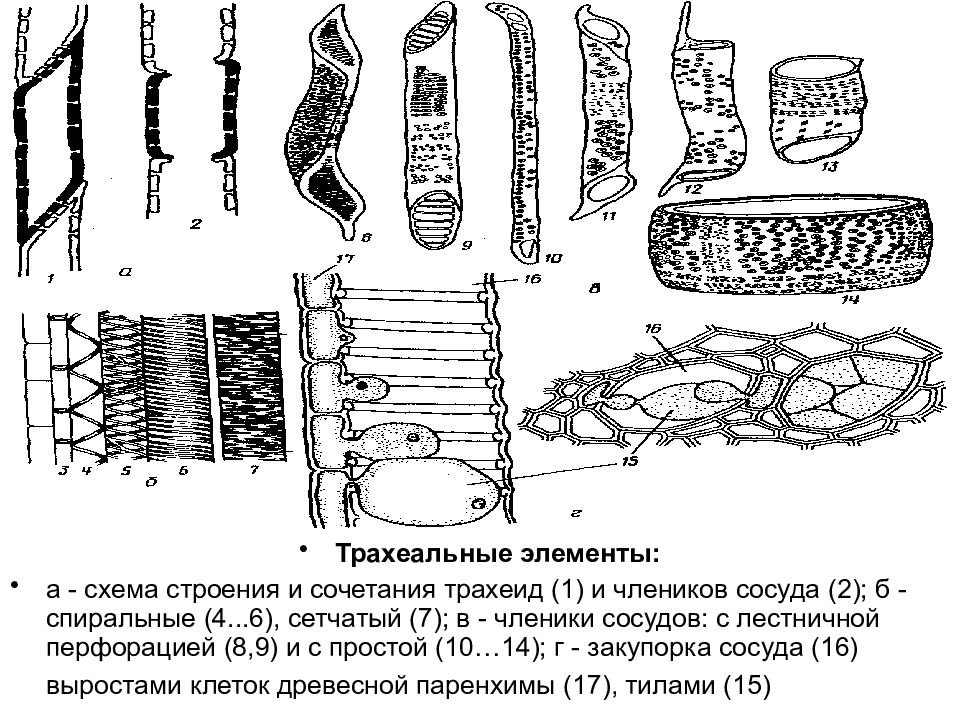 Л. и Робертс, М. Р. 2001. Сигналы, регулирующие множественные реакции на ранения и травоядных животных. Crit. Rev. Plant Sci. 20: 487–521.
Л. и Робертс, М. Р. 2001. Сигналы, регулирующие множественные реакции на ранения и травоядных животных. Crit. Rev. Plant Sci. 20: 487–521.
Артикул Google ученый
Де Мораес, К. М., Льюис, У. Дж., Паре, П. У., Алборн, Х. Т. и Тумлинсон, Дж. Х. 1998. Растения, зараженные травоядными животными, выборочно привлекают паразитоидов. Природа 393: 570–573.
Артикул Google ученый
Ду, Ю.Дж., Поппи, Г. М., Пауэлл, В., Пикет, Дж. А., Вадхамс, Л. Дж., И Вудкок, К. М. 1998. Идентификация полуохимических веществ, выделяемых во время кормления тлей, которые привлекают паразитоидов Aphidius ervi . J. Chem. Ecol. 24: 1355–1368.
Артикул CAS Google ученый
Дюфа М., Хоссарт-Макки М. и Анстетт М. С. 2004. Временные и половые вариации вызываемых листьями запахов, привлекающих опылителей, в карликовой пальме. Oecologia 139: 392–398.
Oecologia 139: 392–398.
PubMed Google ученый
Энгельберт, Дж., Алборн, Х. Т., Шмельц, Э. А. и Тумлинсон, Дж. Х. 2004. Передача по воздуху сигналов основных растений против нападения насекомых-травоядных. Proc. Natl. Акад. Sci. США 101: 1781–1785.
Артикул PubMed CAS Google ученый
Fäldt, J., Jonsell, M., Nordlander, G.и Борг-Карлсон, А. К. 1999. Летучие вещества бобовых грибов Fomitopsis pinicola и Fomes fomentarius и их функции в качестве аттрактантов насекомых. J. Chem. Ecol. 25: 567–590.
Артикул Google ученый
Фараг, М.А. и Паре, П.В. 2002. Летучие вещества С-6-зеленых листьев вызывают локальные и системные выбросы ЛОС в томатах. Фитохимия 61: 545–554.
Артикул PubMed CAS Google ученый
Фрейре, М. Т. Д., Дамант, А. П., Кастл, Л., и Рейес, Ф. Г. Р. 1999. Термическая стабильность полиэтилентерефталата (ПЭТ): распределение олигомеров и образование летучих веществ. Packag. Technol. Sci. 12: 29–36.
Т. Д., Дамант, А. П., Кастл, Л., и Рейес, Ф. Г. Р. 1999. Термическая стабильность полиэтилентерефталата (ПЭТ): распределение олигомеров и образование летучих веществ. Packag. Technol. Sci. 12: 29–36.
Артикул CAS Google ученый
Galliard, T. 1978. Липолитические и липоксигеназные ферменты в растениях и их действие в поврежденных тканях, стр. 155–201, в G. Kahl (ed.). Биохимия тканей хранения раненых растений.Walter de Gruyter & Co., Берлин.
Google ученый
Гервлиет, Дж. Б. Ф., Постумус, М. А., Вет, Л. Е. М. и Дике, М. 1997. Сравнительный анализ летучих веществ в свободном пространстве над различными зараженными гусеницами или неинфицированными пищевыми растениями видов Pieris . J. Chem. Ecol. 23: 2935–2954.
Артикул CAS Google ученый
Gouinguene, S.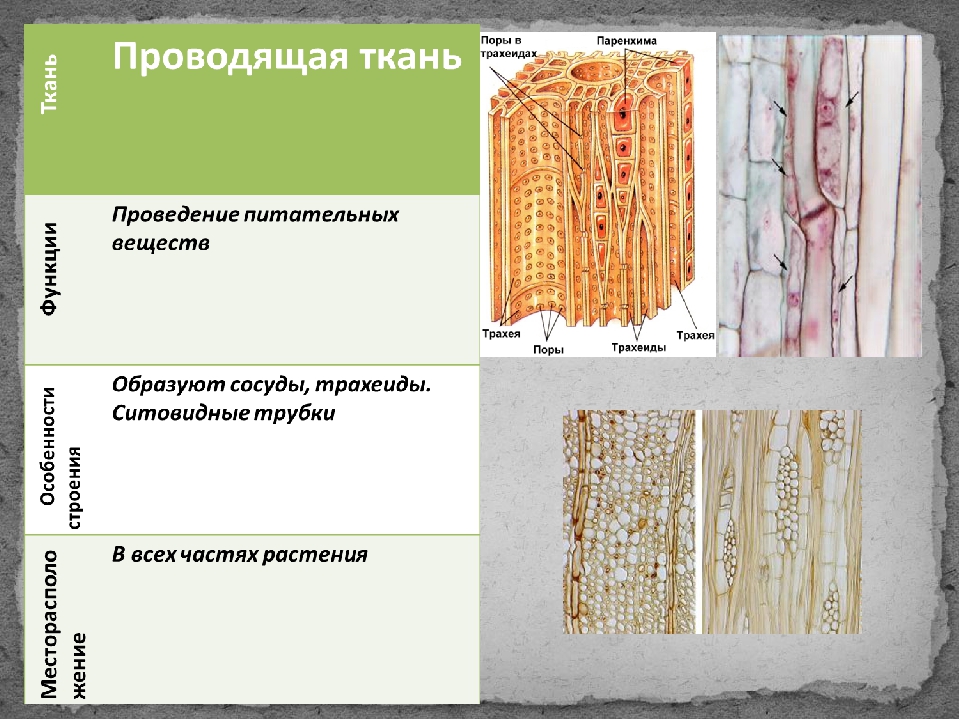 П. и Терлингс, Т. К. Дж. 2002. Влияние абиотических факторов на индуцированные выбросы летучих веществ в растениях кукурузы. Plant Physiol. 129: 1296–1307.
П. и Терлингс, Т. К. Дж. 2002. Влияние абиотических факторов на индуцированные выбросы летучих веществ в растениях кукурузы. Plant Physiol. 129: 1296–1307.
Артикул PubMed CAS Google ученый
Гюнтер А. Б., Монсон Р. К. и Фолл Р. 1991. Изменчивость скорости эмиссии изопрена и монотерпена: наблюдения с эвкалиптом и разработка алгоритма скорости эмиссии. J. Geophys. Res. 96: 10799–10808.
Артикул Google ученый
Halitschke, R., Kessler, A., Kahl, J., Lorenz, A., and Baldwin, I. T. 2000. Экофизиологическое сравнение прямой и косвенной защиты у Nicotiana attuata . Oecologia 124: 408–417.
Артикул Google ученый
Хит Р. Р. и Манукян А. 1994. Автоматизированная система для сбора летучих химикатов, выделяемых из растений. J. Chem. Ecol. 20: 593–608.
Артикул CAS Google ученый
Хеннеман, М. Л., Дайресон, Э. Г., Такабаяши, Дж. И Рагузо, Р. А. 2002. Реакция паразитической осы на обонятельные и зрительные сигналы грецкого ореха Diachasmimorpha juglandis . J. Chem. Ecol. 28: 2221–2244.
Артикул PubMed CAS Google ученый
Хубер, Ф.К., Кайзер, Р., Заутер, В. и Шистл, Ф. П., 2005. Излучение цветочного запаха и привлечение опылителей у двух видов Gymnadenia (Orchidaceae). Oecologia 142: 564–575.
Артикул PubMed Google ученый
Калберер Н. М., Терлингс Т. К. Дж. И Райер М. 2001. Привлечение листоеда ( Oreina cacaliae ) к поврежденным растениям-хозяевам. J. Chem. Ecol. 27: 647–661.
Артикул PubMed CAS Google ученый
Камияма, К. , Takai, T., and Yamanaka, Y. 1978. Корреляция между летучими веществами, выделяемыми растениями, и метеорологическими условиями, стр. 365–372, в E. T. White, P. Hetherington, B. R. Thiele (ред.). Материалы Международной конференции по чистому воздуху . Издательство науки, Анн-Арбор, Мичиган.
, Takai, T., and Yamanaka, Y. 1978. Корреляция между летучими веществами, выделяемыми растениями, и метеорологическими условиями, стр. 365–372, в E. T. White, P. Hetherington, B. R. Thiele (ред.). Материалы Международной конференции по чистому воздуху . Издательство науки, Анн-Арбор, Мичиган.
Карин А. и Карлсон Б. 1990. Химические и этологические исследования опыления у представителей рода Ophrys (Orchidacae). Фитохимия 29: 1359–1387.
Артикул Google ученый
Кнудсен, Дж. Т., Тёлльстен, Л., Грот, И., Бергстром, Г., и Рагузо, Р. А. 2004. Тенденции в химии цветочного запаха при синдромах опыления: Состав цветочного запаха в опыляемых таксонах колибри. Бот. J. Linn. Soc. 146: 191–199.
Артикул Google ученый
Ландон, Ф., Ферари, С., Пьер, Д., Оже, Дж., Biemont, J. C., Levieux, J., and Pouzat, J. 1997. Sitona lineatus Запахи растений-хозяев и их компоненты: влияние на локомоторное поведение и изменения периферической чувствительности. J. Chem. Ecol. 23: 2161–2173.
Артикул CAS Google ученый
Левин Р. А., Рагузо Р. А. и МакДейд Л. А. 2001. Химия запаха и сродство к опылителям у Nyctaginaceae. Фитохимия 58: 429–440.
Артикул PubMed CAS Google ученый
Лафрин, Дж. Х., Манукян, А., Хит, Р. Р., Терлингс, К. Дж. И Тумлинсон, Дж. Х. 1994. Суточный цикл эмиссии индуцированных летучих терпеноидов поврежденными травоядными растениями хлопка. Proc. Natl. Акад. Sci. USA 91: 11836–11840.
PubMed Статья CAS Google ученый
Маттиаччи, Л., Рокка, Б.А., Скаскигини, Н., Д’Алессандро, М., Херн, А., и Дорн, С. 2001. Системно индуцируемые летучие вещества растений, выделяемые во время «опасности». J. Chem. Ecol. 27: 2233–2252.
Артикул PubMed CAS Google ученый
Мукхерджи Д., Тренкл Р. У. и Уилсон Р. А. 1990. Химия фруктов, цветов и специй: живые и мертвые, новое измерение в исследованиях ароматов. Pure Appl. Chem. 62: 1357–1364.
Артикул CAS Google ученый
Мумм, Р., Шранк, К., Вегенер, Р., Шульц, С., и Хилкер, М., 2003. Химический анализ летучих веществ, выделяемых Pinus sylvestris после индукции яиц насекомыми. J. Chem. Ecol. 29: 1235–1252.
Артикул PubMed CAS Google ученый
Паре, П. В. и Тумлинсон, Дж. Х.1997. De novo биосинтез летучих веществ, индуцированный травоядными насекомыми в хлопковых растениях. Plant Physiol. 114: 1161–1167.
PubMed Google ученый
Пеллмир, О., Тьен, Л. Б., Бергстом, Г., и Грот, И. 1990. Опыление новокаледонских озерноцветных — оппортунистические сдвиги или параллельное излучение с их опылителями. Plant Syst. Evol. 173: 143–157.
Артикул Google ученый
Пикетт, Дж.А. и Поппи Г. М. 2001. Включение генов растений внешними химическими сигналами. Trends Plant Sci. 6: 137–139.
Артикул PubMed CAS Google ученый
Пауэлл В., Пеннаккио Ф., Поппи Г. М. и Тремблей Е. 1998. Стратегии определения местонахождения хозяев с помощью паразитоидов Aphidius ervi Haliday (Hymenoptera: Braconidae: Aphidiinae). Biol. Контроль 11: 104–112.
Артикул Google ученый
Кирос, А., Фуэнтес-Контрерас, Э., Рамирес, К. К., Рассел, Г. Б. и Нимейер, Х. М. 1999. Химические вещества растений-хозяев и распространение Neuquenaphis на Nothofagus . J. Chem. Ecol. 25: 1043–1054.
Артикул CAS Google ученый
Рагузо Р. А. и Пеллмир О. 1998. Анализ динамического свободного пространства летучих веществ цветков: сравнение методов. Ойкос 81: 238–254.
Артикул CAS Google ученый
Рагузо, Р.А., Левин, Р. А., Фуз, С. Е., Холмберг, М. В., и МакДейд, Л. А. 2003. Химия ароматов, ночные ритмы и «синдромы» опыления в Nicotiana . Фитохимия 63: 265–284.
Артикул PubMed CAS Google ученый
Родос, Дж. Д., Тейн, Дж. Ф. и Уайлдон, Д. С. 1999. Доказательства физически различных системных сигнальных путей в поврежденном растении томата. Ann. Бот. Лондон 84: 109–116.
Артикул CAS Google ученый
Родригес-Саона, К., Крафтс-Бранднер, С. Дж., И Канас, Л. А. 2003. Летучие выбросы, вызванные множественным повреждением травоядными животными: совка совка и белокрылка, питающиеся хлопчатником. J. Chem. Ecol. 29: 2539–2550.
Артикул PubMed CAS Google ученый
Рохас, Дж. С. 1999. Электрофизиологические и поведенческие реакции капустной моли на летучие вещества растений. J. Chem. Ecol. 8: 1867–1883.
Артикул Google ученый
Розе, США, Манукян, А., Хит, Р. и Тумлинсон, Дж. Х. 1996. Летучие полуохимические вещества, выделяемые из неповрежденных листьев хлопка — системная реакция живых растений на повреждение гусеницами. Plant Physiol. 111: 487–495.
PubMed Google ученый
Рассел, Г.Б., Фаундез, Э. Х. и Нимейер, Х. М. 2004. Отбор деревьев-хозяев Nothofagus тлей Neuquenaphis staryi и Neuquenaphis edwardsi . J. Chem. Ecol. 30: 2231–2241.
Артикул PubMed CAS Google ученый
Шани А. и Клируотер Дж. 1997. Насколько эффективны цельностеклянные системы для улавливания летучих веществ в воздухе? J. Chem. Ecol. 23: 1621–1633.
Артикул CAS Google ученый
Шмельц, Э. А., Слборн, Х. Т. и Тумнлинсон, Дж. Х. 2001. Влияние дизайнов биоанализа на интактных растениях и на вырезанных листьях на вызванные волицитином и жасмоновой кислотой выбросы летучих сесквитерпенов в Zea mays . Planta 214: 171–179.
PubMed CAS Статья Google ученый
Smid, H.A., van Loon, JJA, Posthumus, MA, и Vet, LEM 2002. GC-EAG-анализ летучих веществ из растений брюссельской капусты, поврежденных двумя видами гусениц Pieris : диапазон обонятельного восприятия у специалиста и паразитоидной осы широкого профиля разновидность. Химиоэкология 12: 169–176.
Артикул CAS Google ученый
Смит Р. М., Маршалл Дж. А., Дэйви М. Р., Лоу К. К. и Пауэрс Дж. Б. 1996.Сравнение летучих веществ и восков в листьях генно-инженерных томатов. Фитохимия 43: 753–758.
Артикул CAS Google ученый
Тан, К. Х., Нишида, Р. и Тунг, Ю. К. 2002. Цветочный синомон дикой орхидеи, Bulbophyllum cheiri , приманка плодовых мух Bactrocera для опыления. J. Chem. Ecol. 28: 1161–1172.
Артикул PubMed CAS Google ученый
Тинги, Д.Т., Тернер Д. П. и Вебер Дж. А. 1991. Факторы, контролирующие выбросы монотерпенов и других летучих органических соединений, стр. 93–119, в Т. Д. Шарки, Э. А. Холланд и Х. А. Муни (ред.). Следы выбросов газа заводами. Academic Press, Inc., Сан-Диего.
Google ученый
Töllsten, L. и Bergström, G. 1988. Летучие вещества целых растений и мацерированные части растений Brassica и Sinapis . Фитохимия 27: 4013–4018.
Артикул Google ученый
Тёлльстен Л. и Мюллер П. М. 1996. Летучие органические соединения, выделяемые из листьев бука. Фитохимия 43: 759–762.
Артикул Google ученый
Терлингс, Т. К. Дж., Бернаскони, М., Бертосса, Р., Биглер, Ф., Калоз, Г., и Дорн, С. 1998a. Индуцирование выбросов летучих веществ в кукурузе тремя видами травоядных с разными пищевыми привычками: возможные последствия для их естественных врагов. Biol. Контроль 11: 122–129.
Артикул Google ученый
Терлингс, Т. К. Дж., Ленгвайлер, У. Б., Бернаскони, М. Л., и Векслер, Д. 1998b. Сроки индуцированных выбросов летучих веществ в проростках кукурузы. Planta 207: 146–152.
Артикул CAS Google ученый
Ван Ден Бум, К. Э. М., Ван Бик, Т. А., Постумус, М. А., Де Гроот, А.и Дике, М. 2004. Качественные и количественные вариации среди профилей летучих, вызванные Tetranychus urticae , питающимся растениями из разных семейств. J. Chem. Ecol. 30: 69–89.
Артикул PubMed Google ученый
ван дер Мейден, Э. и Клинкхамер, П. Г. Л. 2000. Конфликт интересов растений и естественных врагов травоядных животных. Ойкос 89: 202–208.
Артикул Google ученый
Visser, J.Х. 1986. Восприятие запаха хозяином у насекомых-фитофагов. Annu. Преподобный Энтомол. 31: 121–144.
Артикул Google ученый
Zhang, Q.-H., Birgersson, G., Zhu, J.-W., Löfstedt, C., Löfqvist, J., and Schlyter, F. 1999. Летучие вещества листьев из лиственных деревьев без призраков: вариации по породам деревьев, сезону, температуре и электрофизиологической активности в Ips typographus . J. Chem. Ecol. 25: 1923–1943.
Артикул CAS Google ученый
Зини, К. А., Аугусто, Ф., Кристенсен, Э., Смит, Б. П., Карамао, Э. Б. и Павлишин, Дж. 2003. Мониторинг биогенных летучих соединений, выделяемых Eucalyptus citriodora с использованием SPME. Анал. Chem. 73: 4729–4735.
Артикул CAS Google ученый
Элементы сосуда двух липтероидных папоротников-часть I | Ботанические исследования
Ampelopteris prolifera ( Retz.) Копель . и T. interrupta (Willd.) K. Iwats, оба растения растут непрерывным участком в придорожных засушливых / заболоченных землях, превосходя также другие компоненты растений соответствующего поля. A. prolifera выращивают в условиях солнечного / теневого земного микроклимата, а T. interrupta всегда предпочитают открытые земли. Растения беспрепятственно вторгались в сильно нарушенные среды обитания путем быстрого размножения. Их распространение наблюдается по всей Западной Бенгалии, и было замечено, что влажная климатическая часть штата благоприятна для их быстрого распространения, потому что эти растения представлены очень бедно или совсем не представлены в более засушливых частях штата.
Сравнение межпопуляционных вариаций длины и ширины трахеальных элементов в разных органах изученных таксонов
Элементы трахеи, т.е. протоксилема, метаксилема и длина-ширина (s) элементов сосуда, а также ширина (s) длины стенки конца сосуда представлены в Таблица 2 для A. prolifera и Таблица 3 для T. interrupta .
Таблица 2 Длина трахеальных элементов и торцевой стенки члена сосуда — ширина (ы) для Ampelopteris prolifera из другой популяции Таблица 3 Длина трахеальных элементов и торцевой стенки члена сосуда — ширина (с) Thelypteris interrupta из другой популяцииВ таблицах 2, 3 самых длинных и самых коротких трахеальных элемента различных органов показаны жирным шрифтом с двойным и одинарным надстрочными индексами соответственно с учетом вариации на уровне популяции.Среди всех трех типов трахеарные элементы в корневых компонентах метаксилемы длиннее и шире во всей популяции из A. prolifera , за исключением популяции 6, то есть P3S, где сосудистые элементы длиннее, чем компоненты метаксилемы. У T. interrupta также компоненты метаксилемы корня длиннее и шире, но в популяции 1 сосудистые элементы шире компонентов метаксилемы. В корневище A. prolifera сосудистые элементы и трахеиды протоксилемы не обнаружены, а компоненты метаксилемы не обнаружены, за исключением популяции 4 i.е. P2S, тогда как у T. interrupta компоненты метаксилемы длиннее двух других элементов, а сосудистые элементы шире метаксилемы. В черешке A. prolifera сосудистые элементы длиннее в четырех популяциях, то есть P1O, P3O, P2S, P3S и компоненты метаксилемы длиннее, чем сосудистые элементы в остальных двух популяциях, то есть P1S и P2S. Компоненты метаксилемы шире, чем сосудистые элементы у P1S, а у остальных пяти популяций сосудистые элементы шире. В т.interrupta компоненты метаксилемы черешка длиннее элементов сосуда. В косте A. prolifera компоненты метаксилемы длиннее, а элементы сосудов шире. У T. interrupta компоненты метаксилемы косты длиннее и шире, чем элементы сосуда.
В A. prolifera самая длинная протоксилема трахеида, то есть 1,49 ± 0,36 мм, наблюдается в корне P1S, а самая короткая длина трахеиды протоксилемы наблюдается в корневище P2S, т.е. 0,20 ± 0.02 мм. Метаксилемные трахеиды корневища отсутствуют во всех популяциях, кроме одной популяции 4 (P2S). Самая длинная трахеида метаксилемы, то есть 6,73 ± 0,63 мм, наблюдалась в корне популяции 2 (P1S), а самая короткая, то есть 2,44 ± 0,047 мм, в корне популяции 4 (P2S). Самый длинный сосудистый элемент был замечен в корне P3S, то есть 7,37 ± 1,80 мм, а самый короткий — в корневище, то есть 1,19 ± 0,16 мм. Самые длинные замыкательные пластинки сосудистого элемента видны на черешке P1O, т.е. 584,40 ± 196,60 мкм у A. prolifera , а самые короткие — в корневище P2S i.е. 65,24 ± 32,9 мкм.
Из T. interrupta самая длинная трахеида протоксилемы была обнаружена в корне популяции 2, т. Е. 1,479 ± 0,005 мм, а самая короткая — в корневище популяции 1, т. Е. 0,564 ± 0,096. Трахеида метаксилемы была самой длинной в корне P2DO, т. Е. 7,79 ± 0,113 мм, и самой короткой в корневище P2DO, т. Е. 2,33 ± 0,014 мм. Элемент корневого сосуда P2 DO был самым длинным, т.е. 5,13 ± 0,105 мм, и самым коротким в корневище P2DO, т.е. 1,325 ± 0,015 мм. У T. interrupta На черешке P1SWO i была видна самая длинная концевая пластина сосуда .е. 640,08 ± 20,28 мкм и самый короткий в корне P2DO 101,01 ± 58,89 мкм.
В обоих таксонах трахеиды протоксилемы имеют спиралевидное утолщение, а трахеиды метаксилемы имеют скалярное утолщение противоположных и чередующихся структур. Торцевые стенки бывают заостренными или конусообразными. Разветвленные трахеиды наблюдаются в пластинке / косте и корневище обоих таксонов.
Сравнение средней длины – ширины трахеальных элементов у исследованных таксонов
В таблице 4 представлено сравнение средней длины – ширины двух таксонов.Среднее таксоновое значение рассчитывали из среднего значения для каждого органа. Среди сосудистых элементов всех органов черешка сосудистые элементы длиннее у A. prolifera , т. Е. 4,77 мм, а корневые сосудистые элементы длиннее у T. interrupta , т. Е. 4,64 мм. Ширина всего органа одинакова у сосудистых элементов A. prolifera , т. Е. 0,04 мм, а среди всех частей растения у T. interrupta сосуды корневища шире, т. Е. На 0,06 мм.
Таблица 4 Сравнение длины-ширины (ов) трахеальных элементов двух изученных таксонов (единица измерения мм)При сравнении двух изученных таксонов трахейные элементы всех типов длиннее в разных органах размером т.interrupta , чем первый, но только элементы сосудов длиннее в корневище A. prolifera , чем второй таксон, но шире у T. interrupta , чем первый. Элементы черешкового сосуда A. prolifera шире второго.
Органографическое распределение сосудистых элементов в изученных таксонах
Сосуды встречаются во всех частях растения, включая срединную жилку / косту пластинки в обоих случаях. Сосуды бывают с наклонной и горизонтальной концевой шайбой.Торцевые пластины бывают с простым (рис. 4в, з), составным (рис. 4г) или промежуточным типом перфорационной пластины (рис. 4а, б). В настоящем наблюдении элементы сосуда присутствуют во всех частях растений (то есть в корне, корневище, черешке, рахисе и в первичной жилке ушных раковин) родов. Уникальность торцевой пластины заключается в наличии полностью (рис. 4d) или не полностью сформированной (рис. 4a, b, g) скалярной перемычки или простой пластины с перфорацией (рис. 4c, h, e) на торцевой стенке. Торцевые стенки всегда расположены наклонно / наклонно, за исключением средней жилы A.пролифера (рис. 3б). В сосудистых элементах первичной вены вторичное утолщение боковой стенки имеет сетчатый тип (рис. 3б), а торцевая стенка имеет тенденцию быть горизонтальной. В соединении корня с корневищем (рис. 3а) и в соединении черешка корневища присутствуют сосудистые элементы.
Рис. 4СЭМ-изображения элементов сосуда Ampelopteris prolifera . a — c Торцевая стенка сосуда корневища a с промежуточным типом перфорационной пластины, изготовлена половина скалярных стержней b с 2–3 остаточными скалярными стержнями. c Простая пластина для перфорации, d Торцевая стенка сосуда (корень) со сложной пластиной для перфорации. e Элемент сосуда (корневище) с удлиненной перфорационной пластиной. f Трахеида спирально утолщенная. г Элемент сосуда с увеличенной торцевой стенкой и промежуточной перфорационной пластиной, связанной с паренхимой ксилемы. h Торцевая стенка емкости с простой перфорационной пластиной. i Торцевая стенка с перфорированной пластиной и боковая стенка с ямочной мембраной.(Используемые сокращения: промежуточная перфорационная пластина ipp , простая перфорационная пластина spp , составная перфорационная пластина cpp , pm пит-мембрана)
Гистохимические и оптические исследования торцевых стенок элементов сосудов
Лигнифицированные ткани флороглюцина Срезы, окрашенные кислотой, имеют красноватый оттенок (рис. 2a, b), а на торцевых стенках сосудов наблюдаются отрицательные реакции. Срезы корня и черешка, на которых видны сосудистые элементы, занимают центральную часть стелы, положительно окрашенную флороглюцин-соляной кислотой (рис.2а, б) и толудиновый синий О (рис. 2в, г). Толудиновый синий O, который окрашивает лигнин синий, не окрашивал торцевую стенку (рис. 2g, h). Стены с пектиновыми веществами окрашены в красный цвет с рутениевым красным (рис. 2д, е). Очень недельное двойное лучепреломление в поляризованном свете от торцевой стенки указывает на их целлюлозную природу, а одревесневшая часть преломляется в кросс-поляризованном свете (рис. 3d, e).
Соединения сосудистых элементов и ассоциаций
Сосуды связаны либо с паренхимой ксилемы с обеих сторон, либо с трахеидами метаксилемы и протоксилемы на другом конце (рис.3в). Элементы сосуда соединяются встык и образуют сеть сосудов (рис. 3c, d). Связи сосуда с сосудами и разрыв сети сосудов наблюдали по части ткани на продольных срезах в белом свете (рис. 3c) и кросс-поляризованном свете (рис. 3d, e).
Судовые сточные воды Часто задаваемые вопросы
Могу ли я слить неочищенные сточные воды?
Сброс неочищенных или недостаточно очищенных сточных вод в пределах трех миль от берега или в зоне, запрещающей сброс (если применимо), является незаконным.
Каковы правила / требования к сбросу сточных вод в США?
- Раздел 312 Закона о чистой воде требует использования исправных, сертифицированных Береговой охраной США морских санитарных устройств (MSD) на борту судов, оборудованных установленными туалетами и работающих в судоходных водах США.
- Неочищенные сточные воды запрещены в пределах трех миль от берега.
- Для сброса в пределах трех миль сточные воды должны обрабатываться с помощью U.S. Утверждено береговой охраной типа I или типа II MSD. В качестве альтернативы сточные воды могут храниться на борту в сборном баке (тип III MSD).
- Сброс очищенных и неочищенных сточных вод запрещен в:
- Пресноводные озера, водохранилища и другие водохранилища пресной воды. Целые входы или выходы предназначены для предотвращения проникновения или выхода судов.
- Реки, не предназначенные для судоходства между штатами.
- Зоны запрета сброса (NDZ) (если применимо).
- На этих территориях сточные воды обычно должны храниться на борту в сборном баке (тип III MSD). Операторы судов, оборудованных проточными МСД (Тип I или Тип II), должны закрепить устройство для предотвращения сброса за борт.
- Посетите веб-страницу государственных зон, запрещающих выбросы (NDZ), для получения дополнительной информации о местонахождении и применимости NDZ.
Могу ли я слить сточные воды с моего судна?
Серые воды регулируются по-разному в зависимости от типа резервуара и от того, смешана ли она со сточными водами.Коммерческие и военные суда предъявляют требования к серым водам в соответствии с разрешительным режимом Национальной системы ликвидации выбросов загрязняющих веществ (NPDES) и Едиными национальными стандартами сбросов, соответственно. Для прогулочных судов в настоящее время нет федеральных правил, регулирующих серые воды.
Для всех судов, когда серые воды и сточные воды смешиваются, результирующий сброс должен соответствовать требованиям к сточным водам.
Как работают различные типы морских санитарных устройств?
Существует три типа морских санитарных устройств (MSD): Тип I, Тип II и Тип III.
МСД типа I — это проточные устройства, которые подходят для судов длиной до 65 футов. Эти устройства используют комбинацию мацерации и дезинфекции для обработки сточных вод с судов. После измельчения твердых частиц сточные воды подвергаются воздействию дезинфицирующих средств (часто таблеток хлора), которые снижают уровень бактерий до уровня ниже установленных пределов в соответствии с Законом о чистой воде. В некоторых случаях бактерицид может быть получен из соленой воды с помощью специальных электродов, поэтому добавление дезинфицирующих средств не требуется.
МСД типа II — это проточные устройства, подходящие для больших сосудов. Устройства типа II — это биологические системы. Во-первых, сточные воды аэрируются, чтобы бактерии, уже присутствующие в сточных водах, могли процветать и начать поглощать / расщеплять сточные воды в качестве источника питания. Как и в случае с устройствами типа I, оставшиеся жидкие отходы затем обрабатываются путем контакта с таблетками хлора, УФ-дезинфекции или других методов дезинфекции. В целом, устройства типа II могут достигать лучших уровней обработки, чем устройства типа I, из-за биологического компонента системы, в отличие от мацерации.
MSD типа III — это сборные резервуары, которые не обрабатывают сточные воды на борту судна. Эти устройства предназначены для хранения сточных вод и предотвращения их сброса за борт.
Какие химические вещества я могу использовать в моем морском санитарном устройстве?
Не все морские санитарные устройства требуют использования химикатов для повседневной работы. Те, кто, скорее всего, полагаются на хлор для очистки сточных вод. Каждое устройство следует обслуживать, как описано в его руководстве, поскольку каждая утвержденная система уникальна.В случае систем, в которых используется хлор, обычно владелец несет ответственность за поддержание надлежащего количества таблеток хлора в системе. Большинство руководств советуют владельцу проверять состояние каждые две недели во время регулярного использования системы, чтобы обеспечить эффективное лечение.
Могу ли я использовать компостный туалет на борту моего судна?
Компостные туалеты могут рассматриваться Береговой охраной США как морское санитарное устройство типа III. Устройства типа III, предназначенные для хранения сточных вод и промывочной воды при атмосферном давлении и температуре, не подлежат официальной сертификации U.S. Береговая охрана, при условии, что устройство соответствует следующему требованию: «Быть спроектированным так, чтобы предотвращать сброс за борт очищенных или неочищенных сточных вод или любых отходов, полученных из сточных вод (Тип III)». Обратите внимание, что большинство компостных туалетов не проверялось Береговой охраной США. Вместо этого в большинстве случаев производитель устройства подтверждает, что устройство соответствует вышеупомянутым требованиям.
Содержимое контейнера для жидких отходов и камеры для компоста должно быть утилизировано надлежащим образом, чтобы не происходило выброса за борт.
См. Соответствующие законодательные формулировки в 33 CFR 159.12 (a) и 33 CFR 159.53 (c).
Как соблюдать запретную зону?
При работе в запретной зоне сброс за борт из морских санитарных устройств, как правило, запрещен. Чтобы закрепить проточное устройство (например, морское санитарное устройство типа I или типа II), операторы судна должны выполнить одно из следующих действий:
- Закройте забортный клапан и снимите ручку;
- Навесной замок забортный клапан в закрытом положении;
- Используйте неразъемную стяжку, чтобы удерживать забортный клапан в закрытом положении; или
- Заприте дверь в пространство между туалетом (-ами) с помощью висячего замка или дверного замка с ключом.
Соответствующие формулировки см. В 33 CFR 159.7 (b) — (c).
Где я могу откачать мой сборный бак (морское санитарное устройство типа III)?
Сборные цистерны должны откачиваться на соответствующем береговом или мобильном (например, грузовом или лодочном) объекте. Обратитесь в местную пристань для яхт или в организацию для яхт, чтобы узнать, на каких объектах есть необходимое оборудование. Многие государственные агентства также хранят информацию о местонахождении откачивающих устройств.
Кто у меня контактное лицо в местном Управлении по охране окружающей среды по вопросам судовых сточных вод?
По вопросам, связанным со сбросом сточных вод с судов и зонами, запрещающими сброс в вашем районе, вы можете связаться со следующими сотрудниками EPA.
Как мне сообщить о нарушении канализации судна?
О нарушениях правил очистки сточных вод с судов следует сообщать в местный офис береговой охраны США или в Национальный центр реагирования, а также в местную пристань для яхт (при необходимости).


 Наблюдение
Наблюдение Сохраняют эластичными стенки капилляров и артерий. Нормализуют ритм сердца и давление.
Сохраняют эластичными стенки капилляров и артерий. Нормализуют ритм сердца и давление.