10. Щелочность почв и ее виды.
ЩЕЛОЧНОСТЬ ПОЧВЫ, физико-химич свойство почвы, функционально связанное с содержанием ионов ОН»». Различают актуальную и потенциальную Щ. п. Актуальная щелочность обусловливается наличием в почвенном растворе гидролитически щелочных солей (NaC03, NaHC03 и др.), которые при диссоциации определяют преобладающую концентрацию гидроксил-ионов, например, Na2C03 + 2HOH ♦* Н2С03 + 2Na + 20H». Актуальная щелочностьбывает: общая, выражающая суммарное содержание в почвенном растворе ионов СОз~ и НС03~, карбонатная, вызванная содержанием в почвенном растворе карбонатного иона СОз , и бикарбонатная, обусловленная содержанием в растворе бикарбонатного иона HCOj». Потенциальная щелочность обнаруживается в почвах, содержащих поглощенный натрий. При взаимодействии такой почвы с угольной кислотой, находящейся в почвенном растворе, происходит реакция замещения, результатом которой является накопление соды и подщелачивание раствора.
Щ. п. выражается в мг-экв. кислоты, необходимой для нейтрализации ионов ОН почвенного раствора, а также показателем рН почвенного раствора или водной вытяжки(слабощелочная — рН = 7,2-^7,5, щелочная — рН = 7,6-^8,5 и сильнощелочная — рН > 8,5). Щелочность угнетает развитие растений и микроорганизмов, усиливает пептизацию почвенных коллоидов и резко ухудшает физические свойства почвы (повышается плотность и твердость, уменьшается пористость и водопроницаемость и др.). Повышенная щелочность (рН > 8,3) нарушает поступление подвижных форм железа из почвы в виноградные растения и обусловливает появление на них хлороза. Избыточную щелочность устраняют гипсованием почвы.
Норму гипса определяют в зависимости от содержания в почве обменного натрия.
11. Элементный состав почв и его задачи.
Элементный состав почв — первая и необходимая химическая характеристика
почв, на которой базируется понимание свойств почв, их
генезиса и плодородия. Без знания элементного состава почв глубокие
почвенно-химические исследования невозможны.
Элементным составом почв называют набор и количественное соотношение
химических элементов в почвенной массе. В качестве синонима
«элементного состава» иногда употребляют термин «валовой состав
почвы», но он менее точен, поскольку не поясняет, о каком именно
составе (химическом, механическом) идет речь. Слово «валовой» означает
«общий», состоящий из всех компонентов. Поэтому часто говорят
о валовом, или общем, содержании элемента в почве, имея в виду все
его количество в почве независимо от форм соединений.
Элементный состав в химии почв и в почвоведении — важнейший
показатель химического состояния почв, их свойств и генезиса. Он используется
для оценки потенциального плодородия почв, а также при
выборе и разработке методов химического анализа почв. Элементный состав в химии почв и в почвоведении — важнейший
показатель химического состояния почв, их свойств и генезиса. Он используется
для оценки потенциального плодородия почв, а также при
выборе и разработке методов химического анализа почв.
Рассмотрим эти направления более подробно.
1. Элементный состав отражает многие и наиболее важные ИТОГИ
почвообразовательного процесса. По элементному составу различаются
генетические горизонты почв; в частности, перегнойно-аккумулятивные
горизонты отличаются повышенным содержанием С, Р, N; в иллювиальных
горизонтах накапливается Fe, A1 и ряд других элементов. В элювиальных
горизонтах повышено количество кремния и понижено содержание
многих других элементов. Иными словами, можно воспользоваться
элементным составом как диагностическим признаком при определении
вида генетического горизонта.
Совокупность элементных составов генетических горизонтов одного
почвенного профиля служит показателем направления почвообразовательного
процесса. В качестве примера на рис. 1 показано распреде-
ление углерода органических соединений и валового содержания железа
по профилю чернозема и дерново-подзолистой почвы. Для чернозема
характерно постепенное убывание с глубиной количества углерода
органических соединений и равномерное распределение железа. Это
свидетельствует о том, что в черноземной почве не произошло заметного
перераспределения по профилю железа (и других минеральных компонентов),
а одним из главных процессов является прогрессирующее
накопление гумуса без последующего его переноса в профиле.
В дерново-подзолистой почве уже только по этим данным выявляются
иные процессы: интенсивное гумусонакопление идет только в самой
верхней части профиля с частичным выносом органического вещества
в иллювиальный горизонт. Распределение железа указывает на его
потерю элювиальным горизонтом (возможно, с разрушением алюмоси-
ликатов) и накопление в иллювиальном горизонте. Верхний максимум
накопления железа совпадает с перегнойно-аккумулятивным горизонтом;
одна из вероятных причин появления этого максимума — биологическое
накопление элемента. Даже эти немногие данные элементного
состава позволили высказать некоторые положения о наиболее важных
процессах, формирующих почвенный профиль. Полный анализ
элементного состава позволяет во многих, хотя и не во всех случаях определить
главное направление процесса, результат почвообразования.
Однако элементный состав ничего не говорит о механизмах протекающих
реакций и не дает возможности выявить те процессы, которые связаны
только с трансформацией, перестройкой веществ в почве, если эта
трансформация не сопровождается пространственной дифференциацией
почвенной массы.
2. Элементный состав позволяет в некоторой степени судить о потенциальном
плодородии почв. Высокое содержание углерода органических
соединений и азота обычно считают признаком плодородной почвы.
Высокий уровень накопления хлора — показатель неблагоприятных
для растений свойств. Конечно, растениям доступна только часть (и не
всегда большая) находящихся в почве элементов питания растений.
Элементы, входящие в кристаллические решетки алюмосиликатов, в состав
труднорастворимых соединений или в состав негидролизуемых компонентов
гумусовых веществ, становятся доступными растениям только
после их мобилизации, т. е. после полного или частичного разрушения
исходной структуры и перехода элемента в форму легкорастворимого
соединения. Тем не менее валовое содержание или запасы элемента
показывают, как долго та или иная почва потенциально может
обеспечивать растения при условии полной мобилизации запасов.
Расчет потенциальной обеспеченности типичного чернозема азотом,
фосфором и калием приведен в табл. 2. Только в слое 0—20 см запасы
азота достигают б—11 т/га, и при урожае пшеницы в 30 ц/га этого может быть
достаточным на 60—100 лет.
Еще больше относительная обеспеченность по фосфору и тем более по калию. Сделанный расчет позволяет оценить только некоторую условную потенциальную возможность почвы при использовании всех запасов.
Практически полная мобилизация всех запасов невозможна, но даже мобилизация ближних резервов, как следует из этих расчетов, в течение десятилетий приводит к истощению почвы.
Полная мобилизация элементов означает полную деградацию, разрушение
почвы, превращение почвы в бесплодную смесь оксидов. Следовательно,
даже из данных элементного состава почв вытекает необходимость
обеспечения бездефицитного баланса всех элементов пита-
«ия в пахотных почвах.
3. Элементный состав — один из важнейших факторов, который
обусловливает выбор методов химического и физико-химического ана-
лиза почв. Любая почва содержит большой набор элементов, причем
содержание их колеблется от десятков процентов до 10~9—10_10%. Многие
элементы оказывают взаимное мешающее влияние при химическом
анализе, причем соотношение мешающих и определяемых элементов
часто складывается очень неблагоприятно. Поэтому при химическом
анализе почв широко используются методы концентрирования и различные
приемы отделения определяемых элементов от мешающих выполнению
анализа.
Элементный состав почвы и ее гранулометрических фракций может
быть использован как дополнительный диагностический признак при
идентификации почвенных минералов, особенно в тонкодисперсных
фракциях.
Кислотность и щелочность почвы
Всякая почва обладает определенной реакцией, которая проявляется при взаимодействии с водой или растворами солей и может быть кислой, щелочной и нейтральной.
Кислотность почвы. Почвы, не насыщенные основаниями, обладают кислотностью, которая вызывается ионами водорода. В зависимости от того, в каком состоянии они находятся в почве, кислотность может быть активной, или актуальной, и потенциальной.
Под активной кислотностью понимают концентрацию свободных водородных ионов в почвенном растворе.
Источниками свободного водорода в почвенном растворе могут быть растворимые органические кислоты, образующиеся после разложения органических остатков, и углекислота, возникающая при растворении углекислого газа в воде. Углекислота, диссоциируя на Н+ и HCOj», подкисляет почвенный раствор. Активная кислотность частично вызывается и десорбцией обменных ионов водорода поглощающим комплексом.
Факторами активной кислотности в почве могут быть и некоторые минеральные соли А1 и Fe. Известно, что соли слабых оснований и сильных кислот в водных растворах гидролитически расщепляются, освобождая кислоту. Примером может служить хлористый алюминий, который при взаимодействии с водой расщепляется следующим образом:
А1С13 + ЗНаО = А1 (ОН)3 + ЗНС1.
Образующаяся при этом соляная кислота создает кислую реакцию раствора.
Эти явления наблюдаются только в почвах, не насыщенных основаниями. В почвах, насыщенных основаниями, активной кислотности нет.
Активная кислотность определяется в лабораториях в водной вытяжке из почвы. Количественно она выражается символом рН, который представляет собой отрицательный десятичный логарифм концентрации водородных ионов в почвенном растворе. При кислой реакции раствора рН меньше 7, при нейтральной равен 7, а при щелочной больше 7.
По величине рН почвы делят на следующие группы:
Сильнокислые 3—4
Нейтральные 7
Кислые 4—5,5
Щелочные 7—8
Слабокислые 5,5—6,5
Сильнощелочные 8—9
Кислую реакцию имеют подзолистые, дерново-подзолистые и болотные почвы, нейтральную — главным образом черноземы, щелочную — каштановые почвы, сероземы и солонцы.
Потенциальная кислотность обусловлена ионами водорода и алюминия, находящимися в поглощенном состоянии.
Кроме поглощенного водорода, обменную кислотность в почве создают обменнопоглощенные ионы алюминия, которые при взаимодействии с растворами нейтральных солей могут переходить в раствор.
Обменная кислотность наиболее ярко выражена в подзолистых почвах и красноземах. В почвах, имеющих слабокислую, нейтральную и щелочную реакцию, обменная кислотность не проявляется.
Водородные ионы поглощающего комплекса, вытесняемые гидролитически щелочными солями (образованными сильными основаниями и слабыми кислотами), обусловливают гидролитическую кислотность.
К гидролитически щелочным солям относятся, например, уксуснокислый натрий Ch4COONa и уксуснокислый кальций Са(СН3С00)2. Эти соли в водных растворах гидролитически расщепляются на слабую кислоту и сильное основание, которое придает раствору щелочную реакцию, при этом происходит более полное вытеснение поглощенного водорода.
Для определения гидролитической кислотности в лаборатории чаще всего используют уксуснокислый натрий.
Уксуснокислый натрий в воде гидролитически распадается на щелочь и слабую уксусную кислоту:
Ch4COONa + НОН = СН3СООН + NaOH.
При взаимодействии уксуснокислого натрия с подзолистой почвой натрий щелочи вступает в поглощающий комплекс и вытесняет поглощенный водород:
[почва] и + NaOH + СН3СООН = [почва] Na + Н,0 + СН3СООН.
Гидролитически щелочные соли вытесняют из поглощающего комплекса водорода больше, чем нейтральные соли. Поэтому наиболее полное представление о количестве поглощенных водородных ионов в почве можно получить на основании определения гидролитической кислотности.
Величину обменной и гидролитической кислотности почвы определяют титрованием солевой вытяжки щелочью (NaOH) и выражают в миллиграмм-эквивалентах на 100 г почвы. Обменную кислотность, кроме того, выражают в единицах рН путем определения концентрации водородных ионов в солевой вытяжке потенциомст-рически или колориметрически.
Почвенная кислотность неблагоприятна для развития растений и микроорганизмов и ведет к понижению плодородия почв. Устранение кислотности почв достигается известкованием, при котором происходит замещение поглощенного водорода на кальций:
Н г
[почва] и + Са (НС03)25: [почва] J? + 2НгО + 2С02. Н
Щелочность почвы. Почвы, в поглощающем комплексе которых находится натрий, имеют щелочную реакцию. Она обусловливается главным образом содой, образующейся в результате обмена поглощенного почвой натрия на водород углекислоты:
[почва] + Н2С03 ?> [почва] fj + Na2C03.
Широко распространен в природе и биологический процесс образования соды. Сульфатредуцирующие бактерии восстанавливают в анаэробных условиях в присутствии органического вещества сернокислые соли натрия до Na2S, который затем превращается в соду:
Na2S04 + 2С = 2С02 +Na2S;
Na2S + С02 + НгО = Na2C03 + HaS.
Высокая щелочность резко ухудшает физические и водные свойства почвы, усиливает пептизацию коллоидов, угнетает развитие растений, нарушая ход физиологических процессов.
Для устранения щелочности проводят гипсование:
[почва] [jj + CaS04it [почва] Са + Na, S04.
Сернокислый натрий легко вымывается из почвы, так как хорошо растворим в воде.
Почвенно-поглощающий комплекс (ППК)
Поглотительной способностью обладают коллоиды (частицы 0,2 – 0,001 мкм), предколлоидная фракция 1– 0,2 мкм. Характерной особенностью их является большая удельная поверхность. Это и определяет их высокую химическую активность.
Коллоиды подразделяются на
— минеральные
— органические
Часть минеральных коллоидов находится в кристаллическом состоянии. Это в основном минералы.
Другая часть минеральных коллоидов представляет собой аморфные вещества: к ним относят аллофаны, свежеосажденные гидраты полуторных оксидов ( Fe(OH)3, Al (OH)3, Mn (OH)3 ), гидраты кремнезема и их комплексные осадки (коагели).
Органическая часть почвенных коллоидов – аморфные гумусовые вещества, органо-минеральные комплексы, клетки мелких бактерий.
В большинстве почв преобладают минеральные коллоиды. Они составляют 85-90% их общей массы коллоидов. При физико-химической адсорбции поглощаются отдельные ионы (катионы и анионы). Адсорбция связана с наличием на поверхности коллоидных частиц положительного или отрицательного зарядов. Появление заряда на поверхности коллоидов, имеющих кристаллическое строение связано с некомпенсированностью зарядов ионов кристаллической решетки, расположенных на поверхности раздела твердая частица — раствор. Появление заряда в кристаллических и аморфных коллоидах, может быть обязано диссоциации ионов поверхностного слоя в окружающую среду.
Биология для студентов — 15. Кислотность и щелочность почвы. Мероприятия по их регулированию
Реакция почвы определяется наличием и соотношением в почвенном растворе водородных Н+ и гидроксильных ОН- ионов.
В дистиллированной воде концентрация ионов водорода и гидроксила, образующихся при слабой диссоциации, равна и ее реакция нейтральна. Когда концентрация ионов водорода выше, чем концентрация гидроксильных ионов, раствор приобретает кислую реакцию, при обратном соотношении – щелочную. Реакция почвенного раствора характеризуется рН – показателем концентрации водородных ионов, представляющий собой отрицательный логарифм активности водородный ионов растворе (при рН 7 реакция нейтральна, при рН>7 – щелочная, при рН<7 – кислая). Реакция почвы зависит от многих факторов, и, прежде всего от:
- химического состава,
- состава обменно-поглощенных катионов,
- наличия солей, органических и минеральных кислот,
- жизнедеятельности организмов.
Под кислотностью почвы понимают ее способность подкислять почвенный раствор, имеющимися в почве кислотами обменно-поглощенными катионами водорода, а также алюминия, способного при вытеснении из ППК образовывать гидролитически кислые соли. В зависимости от реакции почвенного раствора различают строго определенные уровни кислотности и щелочности:
- сильнокислая <4,5,
- кислая 4.6 – 5,
- слабокислая 5.1 – 5.5,
- близкая к нейтральной 5,6 – 6,
- нейтральная 6,1 – 7,1,
- слабощелочная 7.2-7,5,
- щелочная 7.6 – 8,5,
- сильнощелочная >8,5.
В зависимости от того, в каком состоянии находятся в почве ионы Н и Al, кислотность может быть активной или актуальной и потенциальной.
Под активной (актуальной) понимают концентрацию свободных водородных ионов в почвенном растворе. Источником свободного Н в почвенном растворе могут быть растворимые органические кислоты, образующиеся после разложения органических остатков, и углекислота, при растворении углекислого газа в воде. Активная кислотность частично вызывается и десорбцией обменных ионов водорода поглощающим комплексом. Факторами активной кислотности в почве могут быть и некоторые минеральные соли Al и Fe. Известно, что соли слабых оснований и сильных кислот в водных растворах гидролитически расщепляются освобождая кислоту. Примером может служить хлористый Al , который при взаимодействии с водой расщепляется специальным образом:
AlCl3 + 3H2O = Al (OH)3 + 3HCl .
Образующаяся соляная кислота придает раствору кислую реакцию. Это явление наблюдаются в почвах, ненасыщенных основаниями. В почвах, насыщенных основаниями, активной кислотности нет.
Потенциальная кислотность –обусловлена ионами Н и Al, находящиеся в поглощенном состоянии.
Потенциальная кислотность подразделяется на обменную и гидролитическую.
Обменная кислотность –та часть потенциальной кислотности, которая определяется при взаимодействии с почвой раствора гидролитически нейтральной соли КCl. При этом катион К вытесняет из ППК обменно – поглощенные катионы, среди которых H, Al, Fe подкисляют солевую вытяжку, образуя кислоту HCl.
Гидролитическая кислотность –это та часть потенциальной кислотности, которая определяется при взаимодействии с почвой раствора гидролитически щелочной соли СН3СООNa с рН 8,2. в этом случае катион Na вытесняет обменно-поглощенный Н, Al и другие катионы в процессе эквивалентного обмена. При этом щелочная реакция раствора соли уксуснокислого Na способствует более интенсивному вытеснению из ППК обменно-поглощенных катионов.
Аналогично почвенной кислотности различают актуальную и потенциальную щелочность почвы. Актуальная щелочность обусловлена содержанием в почве гидролитически щелочных солей, это преимущественно карбонаты щелочных и щелочноземельных металлов: сода, поташ, гидрокарбонаты кальция и магния и др. Определяется актуальная щелочность значением рН водной вытяжки или путем титрования водной вытяжки кислотой с последующим выражением результатов в мг экв на 100 г почвы.
Потенциальная щелочность определяется содержанием обменно-поглощённого катиона натрия, который переходя в раствор подщелачивает его.
Кислую реакцию имеют подзолистые, дерново-подзолистые и болотные почвы; нейтральную – главным образом чернозёмы; щелочную – каштановые, серозёмы и солонцы.
Химический состав материала, из которого формируется почва, – определяющий фактор ее кислотности. Например, почвы, сформированные на известковых сланцах или известняке, имеют высокое изначальное значение рН. Для того чтобы они стали кислыми, нужно больше времени, чем для тех, которые образовались на гранитах и песчанике. Кроме того, на кислотно-щелочной баланс (рН) почвы влияет геологический возраст ландшафта – время, в течение которого из исходного материала формировалась почва. Чем длиннее период воздействия погодных условий и чем интенсивнее этот процесс, тем больше будет удалено из почвы исходного материала и, следовательно, будет ниже рН. Там, где годовой уровень осадков превышает годовую норму испарения и влага накапливается в почве, существует высокий потенциал выщелачивания растворимых солей и основных минералов вниз по профилю почвы, за пределы корневой зоны. Постепенно почва становится более кислой. Выщелачивание в процессе орошения может также стать причиной повышения кислотности почвы, в зависимости от интенсивности применения воды и ее щелочного баланса (рН)..
Почвы становятся кислыми вследствие вытеснения ионами водорода H+ катионов кальция, магния, натрия и калия. Процесс этот обратимый, pH почвы можно повысить внесением этих элементов. Но наиболее экономично использовать кальций. Кальций наиболее экономичен для повышения pH почвы, кроме того, он:
- является очень важным элементом питания растений,
- улучшает структуру почвы,
- делает ее рассыпчатой, гранулированной,
- стимулирует развитие полезных почвенных микроорганизмов, особенно бактерий обогащающих почву азотом.
Подобными свойствами обладает и магний, часто эти элементы используют вместе. Внесение кальциевомагниевых соединений приводит к значительному улучшению роста растений. Внесение кальция или кальциевомагниевых соединений с целью снижения кислотности называется известкованием. Известкование проводят с целью довести pH почвы до слабокислой (pH 6,5).
Материалы для известкования:
- гашеная известь — CaO. Перед использованием следует погасить, т.е. смочить водой до рассыпчатого состояния. В результате реакции образуется гашеная известь — пушенка. Содержат только кальций, и не содержат магния.
- молотый известняк (мука) — CaCO3, кроме кальция содержие до 10% карбоната магния MgCO3. Чем тоньше помол известняка, тем лучше. Один из наиболее подходящих материалов для раскисления почвы.
- доломитовый известняк (мука) содержит до 50% доломита (CaCO3 * MgCO3), не менее 13-23% карбоната магния. Один из лучших материалов для известкования почвы мел (в измельченном виде),
- мергель (илистый материал, в основном состоящий из карбоната кальция. Если имеет примесь земли, то норму внесения следует увеличить).
- мартеновский шлак (в измельченном виде),
- ракушечник (в измельченном виде).
Избыточно щелочные почвы промывают водой и вносят кислые удобрения — сернокислый аммоний.
8. Щелочность и кислотность почв
По формам проявления кислотных и щелочных свойств почв принято различать актуальную и потенциальную кислотность и щелочность.
Актуальные кислотность и щелочность характеризуются концентрацией ионов водорода и гидроксила в почвенном растворе.
Степень кислотности и щелочности почвенных растворов, вытяжек и суспензий оценивают величиной рН. Количественно кислотность и щелочность определяют по содержанию титруемых, соответственно, щелочами (обычно NaOH) или кислотами (НС1) веществ, обладающих кислыми или щелочными свойствами.
На практике чаще измеряют рН водной вытяжки или водной суспензии, а не рН почвенных растворов. Кислотность почвенных растворов связана с присутствием в почвах свободных органических (главным образом гумусовых) и неорганических (преимущественно угольной) кислот и других органических и минеральных соединений, способных оказывать влияние на кислотно-основное равновесие в почвенных растворах. Среди таких органических компонентов почв следует назвать соединения, содержащие фенольные ОН-группы, а среди минеральных компонентов – соединения, содержащие катионы А13+ и Fe3+, кислотные свойства которых соизмеримы с кислотными свойствами таких кислот, как угольная и уксусная.
В водных растворах, как известно, произведение констант основности и кислотности соответствующих кислотно-основных пар равно ионному произведению воды. Ионное произведение чистой воды меняется при атмосферном давлении от 0,1139 • 10–14 (0°С) до 9,614 • 10–14 (60°С), а около 25°С имеет значение 1,008 • 10–14. Поэтому для почвенных растворов обычно принимают:
КаКb =10–14 или рКа + рКb = 14, (10)
где Ка и Кb– константы кислотности и основности соответственно;
рКа и рКb – отрицательные логарифмы соответствующих констант.
Для наиболее характерных сопряженных кислотно-основных пар, встречающихся в почве, кислотность и основность характеризуются следующими значениями рКа и рКb (по Л. А. Воробьевой):
рКb | Реакция | pKa |
0,2 | S2– + H2O | 13,8 |
1,6 | РО | 12,4 |
3,7 | Cо | 10,3 |
4,6 | H3SiO | 9,4 |
4,9 | H2BO | 9,1 |
6,8 | НРО | 7,2 |
7,0 | HCO | 7,0 |
7,6 | HS– + H2O | 6,4 |
Сравнение значений
констант основности соответствующих
кислотно-основных пар показывает, что
наиболее сильными основными свойствами
в почвах обладают ионы S2–,
PO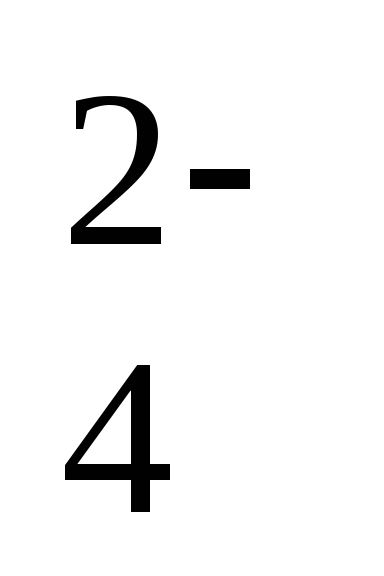 и СО
и СО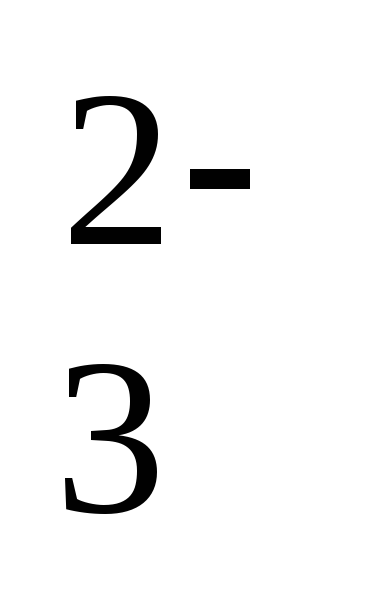 .
.
Определенного
вклада в щелочность следует ожидать и
от ионов H3SiO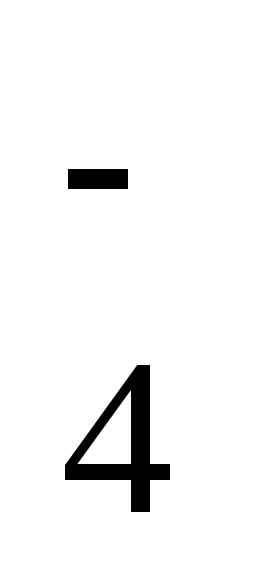 и Н2ВО
и Н2ВО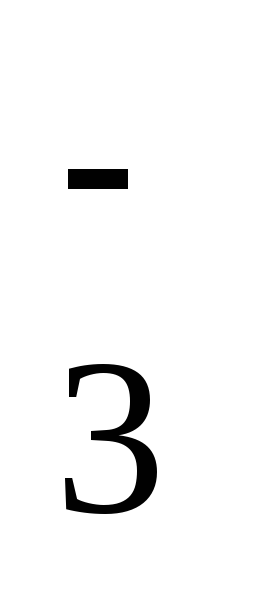 .
Однако в реальных условиях, поскольку
вклад в формирование щелочности зависит
не только от константы основности, но и от
концентрации соответствующих ионов, в
большинстве случаев щелочность
определяется присутствием карбонат-ионов.
Рассмотренное ранее при анализе карбонатного
равновесия в природных водах уравнение
позволяет связать активность ионов
водорода в растворе с равновесным
значением парциального давления СО2 над ним и произведением растворимости
карбоната кальция, характеризующим
твердую фазу карбонатной системы:
.
Однако в реальных условиях, поскольку
вклад в формирование щелочности зависит
не только от константы основности, но и от
концентрации соответствующих ионов, в
большинстве случаев щелочность
определяется присутствием карбонат-ионов.
Рассмотренное ранее при анализе карбонатного
равновесия в природных водах уравнение
позволяет связать активность ионов
водорода в растворе с равновесным
значением парциального давления СО2 над ним и произведением растворимости
карбоната кальция, характеризующим
твердую фазу карбонатной системы:
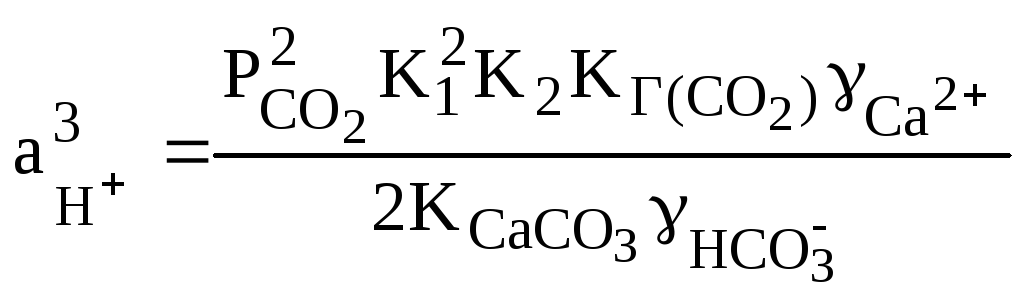 ,
(11)
,
(11)
где аН+ – активность ионов водорода в растворе;
Рсо2 – парциальное давление СО2;
К1 и К2 – константы диссоциации угольной кислоты по первой и второй ступеням соответственно;
КГ(СО2) – константа Генри для диоксида углерода;
Са2+ и hco –
коэффициенты активности соответствующих
ионов;
–
коэффициенты активности соответствующих
ионов;
ПРСаСО3 – произведение растворимости карбоната кальция.
В случае, когда почвенные воды находятся в равновесии с атмосферным воздухом и кальцитом, рН раствора составит около 8,3. Присутствие магнезита MgCO3 может увеличить рН до 10,0 -11,0. В случае отсутствия карбонатов кальция и магния в почве и увеличения концентрации диоксида углерода в почвенном воздухе рН раствора снижается и при содержании СО2, равном 5 -10 % (об.), может упасть примерно до 4.
Потенциальные кислотность и щелочность почв проявляются в результате различных воздействий на почву. В настоящее время понятие потенциальной кислотности почв разработано значительно более подробно, чем понятие потенциальной щелочности, сведений о которой недостаточно.
Потенциальную кислотность почв принято определять при воздействии на почву растворов хлорида калия (обычно 1 н. раствор КС1) – обменная кислотность – или растворов гидролитически щелочной соли (обычно 1 н. раствор CH3COONa) – гидролитическая кислотность.
Обменную кислотность оценивают по величине рН солевой вытяжки. Для количественного определения кислотности солевую вытяжку титруют раствором щелочи.
В случае обработки почвы раствором КСl возможны следующие реакции обмена катионов почвенно-поглощающего комплекса:
ППК-Н+ + КСl ППК-К+ + НСl; (12)
ППК-А13+ + 3КСl
ППК-К +А1Сl3. (13)
+А1Сl3. (13)
В дальнейшем, при титровании солевой вытяжки раствором NaOH, в реакцию вступают НС1 и А1С13:
HCl + NaOH NaCl + Н2О; (14)
AlCl3 + 3NaOH 3NaCl + А1(ОН)3. (15)
Ионы А13+,
выделенные из почвенно-поглощающего
комплекса в раствор, оказывают влияние
на степень кислотности, поскольку в
водных фазах образуются ионы A1(OH) и А1(ОН)2+.
и А1(ОН)2+.
Процесс ионного обмена, протекающий при обработке почвы раствором CH3COONa, можно представить уравнением:
ППК-Н+ + CH3COONa ППK-Na++ CH3COOH. (16)
Уксусная кислота, образующаяся в этом случае, как известно, значительно слабее, чем соляная, выделяющаяся при обработке почв растворами КСl. Поэтому процесс обмена по реакции (16) протекает более глубоко, чем по реакции (12), и величина гидролитической кислотности всегда выше, чем величина обменной кислотности. Значения рН водной вытяжки после обработки почвы 1 н. раствором CH3COONa обычно находятся в интервале 6,2 — 7,5 в отличие от рН 3,0 — 6,5, характерного для случая обработки почв раствором КС1. Интервал рН 6,2-5-7,5 соответствует области минимальной растворимости А1(ОН)3, поэтому, хотя А13+ и оказывает влияние на величину гидролитической кислотности и участвует в обмене катионов, в водной вытяжке, полученной при обработке почв раствором CH3COONa, соединений алюминия практически нет.
Изучение природы потенциальной кислотности почв, как отмечал в своих работах Д. С. Орлов, имеет не только важное теоретическое или познавательное значение, но от решения этого вопроса зависит и правильный выбор приемов борьбы с почвенной кислотностью.
Как показали экспериментальные исследования, для почв характерен самопроизвольный переход от насыщения катионами Н+ к насыщению А13+. Так, любые почвы тем или иным способом можно насытить катионами Н+ и перевести их в состояние, когда в составе обменных катионов будут преобладать катионы водорода, однако со временем в такой почве в составе обменных катионов появятся катионы А13+, количество которых постепенно будет увеличиваться.
Д. С. Орлов объясняет
этот процесс на примере трансформации
кристаллической решетки каолинита
следующим образом: на сколе кристалла
каолинита образуются избыточные
отрицательные заряды, удерживающие
обменные катионы. При обработке таких
кристаллов растворами кислот происходит
обмен катионов металлов на ионы Н+.
Однако, поскольку катионы Н+ имеют значительно меньшие размеры, чем
катионы металлов, они способны мигрировать
во внутренние слои решетки. В дальнейшем
они способны вступать во взаимодействие
с ОН-группами и образовывать молекулы
воды или новые ОН-группы, соединяясь с
атомами кислорода. В результате таких
преобразований ион А13+,
занимавший центральное место в
алюмогидроксильном октаэдре, превращается
в ион A1(OH) (или А1(ОН)2+)
и становится способным к ионному обмену
с катионом другого металла. Часть
кристаллической решетки алюмосиликата
при этом разрушается. Такие циклы
превращений «почва-Ме
почва-Н+
почва-А13+
почва-Ме» могут повторяться из года в
год, вызывая разрушение алюмосиликатной
составляющей почв.
(или А1(ОН)2+)
и становится способным к ионному обмену
с катионом другого металла. Часть
кристаллической решетки алюмосиликата
при этом разрушается. Такие циклы
превращений «почва-Ме
почва-Н+
почва-А13+
почва-Ме» могут повторяться из года в
год, вызывая разрушение алюмосиликатной
составляющей почв.
формы, происхождение, агрономическое значение, приемы регулирования.
Реакция почвы – это обусловленная состоянием поглощенных катионов способность почвы подкислять или подщелачивать взаимодействующие с ней растворы солей или воду. Кислотность почв подразделяется на актуальную и потенциальную.
Актуальная кислотность обусловлена наличием ионов Н+ и активностью протонов водорода в почвенном растворе. Измеряется величиной рН водной вытяжки. В разных почвах колеблется от 3 до 7.
Потенциальная кислотность обусловлена наличием ионов водорода и алюминия в поглощенном состоянии в составе ППК. Она подразделяется на обменную и гидролитическую. Обменная кислотность создается Н, Al, Fe (более подвижными) способными вытесняться в раствор при действии на почву гидролитически нейтральных солей (в т.ч. удобрений NaNO3, K2SO4 и др.)
Al 3К
ППК)Н + nKCl = ППК)К + (n – 7)KCl + HCl + AlCl3 + FeCl3
Fe 3К
AlCl3 + 3Н2О = Al(OH)3 + 3HCl
FeCl3 + 3Н2О = Fe(OH)3 + 3HCl
Чаще всего обменная кислотность выражается как рНkcl, или м-экв/100 г почвы. Показатель рН колеблется от 2,5 до 6,5. В почвах насыщенных основаниями обменная кислотность не определяется.
Гидролитическая кислотность обусловлена Н, Al, Fe (более прочно связанными с ППК) не вытесняющимися раствором нейтральной соли. Определяется обработкой почвы раствором гидролитически щелочной соли: 1н. Ch4COONa.
Реакции:
Al 3Na
ППК)Н + nCh4COONa = ППК)Na + (n – 7)Ch4COONa + 7Ch4COOH + Al(ОН)3 + Fe(ОН)3
Fe 3Na
Гидролитическая кислотность выражается в м-экв/100 г почвы. Включает в себя: актуальную, обменную, и собственно гидролитическую. Собственно гидролитическая характеризуется слабой подвижностью и в отсутствии актуальной и обменной форм (например в черноземах) не оказывает вредного влияния на растения.
Показатели гидролитической кислотности используются в расчетах доз извести. Также уменьшению кислотности способствует систематическое применение навоза и компостов.
Щёлочность почв.В щелочных почвах (ю. черноземах, каштановых, солонцах)
Выделяют:
1) Актуальная
2) Потенциальная
Актуальная обусловлена наличием в растворе гидролитически щелочных солей. Определяется при обработке почвы водой и выражается в рНн2о или м-экв/100 г почвы. Потенциальная связана с нахождением ионов Na в ППК. По величине щелочности определяют нуждаемость почв в гипсовании, а по доле Na в ППК рассчитывают дозы гипса. Реакция почвы оказывает большое влияние на агрохимические, агрофизические свойства почв, превращение питательных веществ, жизнь м.о. Приемы химической мелиорации направлены на создание слабокислой или нейтральной реакции среды, благоприятной для большинства растений.
9.Структура почвы: виды, основные показатели, классификация, условия и механизмы формирования, причины разрушения и пути восстановления. Оценка структурного состояния почвы. Агроэкологическая роль структуры.
Совокупность агрегатов разной величины, формы и качественного состава называется структурой почвы.
Различают следующие главнейшие виды почвенной структуры.
Зернистая структура почвы. Структурные отдельности более или менее ясно ограниченной формы с шероховатой поверхностью диаметром 0,5-5,0 мм. Эта структура, присущая почвам со значительным содержанием перегноя, образуется при воздействии корневой системы травянистой растительности. Имеются указания на большую роль дождевых червей в ее образовании. Как переходная форма встречается зернистая структура с острореберной поверхностью. По виду она напоминает зерно гречихи (отсюда начтите «крупитчатая»).
Комковатая структура. Отличается от зернистой большим разбором и меньшей прочностью. Имеет неправильную округлую корму с относительно шероховатой поверхностью. Различают мелко-комковатую структуру с диаметром 0,5-3,0 см и крупно-комковатую с диаметром 3-5 см.
Глыбистая структура. Структурные отдельности неправильной формы размером в поперечнике от 5 до 10 см и больше.
Морфологические типы структур почвенной массы хорошо разработаны С. А. Захаровым, вот его классификация:
I тип Кубовидный (равномерное развитие структуры по трем взаимно перпендикулярным осям): 1) крупнокомковатая, 2) среднекомковатая, 3) мелкокомковатая, 4) пылеватая, 5) крупноореховатая, 6) ореховатая, 7) мелкоореховатая, 8) крупнозернистая, 9) зернистая, 10) порошистая.
II тип Призмовидный (развитие структуры главным образом по вертикальной оси): 11) столбчатая, 12) столбовидная, 13) крупнопризматическая, 14) призматическая, 15) мелкопризматическая, 16) тонкопризматическая.
III тип Плитовидный (развитие структуры по горизонтальным осям): 17) сланцевая, 18) пластинчатая, 19) листоватая, 20) грубочешуйчатая, 21) мелкочешуйчатая.
Образование структуры происходит под влиянием ряда факторов:
Физические: изменение давления под действием замораживания-оттаивания, увлажнения-высушивания, давлении к.с. растений.
Физико-химические: главная роль принадлежит почвенным коллоидам обладающим клеящей способностью.
Химические: химические реакции, в результате которых образуются труднорастворимые соединения.
Биологические: корни растении, м.о., дождевые черви, насекомые.
Разрушение почвенной структуры происходит под действием агрогенных факторов. Обработки почвы приводят к механическому разрушению структурных агрегатов и усиливают биологические потери гумуса. Тяжелая техника вызывает переуплотнение пахотного и подпахотного слоев. Минеральные удобрения при грамотном применении улучшают почвенную структуру за счет увеличения массы корней растений. Использование в повышенных дозах физиологически кислых удобрений на почвах с кислой реакцией среды и физиологически щелочных – на почвах со щелочной реакцией приводят к ухудшению структурного состояния.
Орошение и ирригационная эрозия могут вызвать ухудшение структуры при избыточном поливе и интенсивном дождевании.
Способы восстановления и сохранения структуры:
Снижение степени выпаханности почв(травосеянье, внесение органики и мин. Уд., минимализация обработок)
Проведение обработок в периоды физической спелости почв
Использование легкой техники при обработках
Химическая мелиорация
Противоэрозионные мероприятия
Применение искусственных структурообразователей.
Щелочность почвы. Формы, происхождение, агрономическое значение. Пути регулирования почвенной кислотности. Буферные свойства почв.
⇐ ПредыдущаяСтр 10 из 22Следующая ⇒
Щелочность почвы — содержание в почвенном растворе OH— иона. Ее значение рН больше 7. Выделяют актуальную и потенциальную щелочность.
Щелочность почвы — повышенное содержание в почве щелочных солей, главным образом карбонатов натрия или магния. Щелочность почв гибельна (токсична) для большинства растений, она способствует солонцеватости или содовому засолению. Щелочность почв характерна для лесостепной и степной зон при большой испаряемости и слабой дренированности.
Щелочность почв. Щелочными считают почвы, водная суспензия которых имеет рН 7,5 — 8,0 или выше. Эти почвы формируются в степных и сухостепных природных зонах; к ним относятся солонцы, некоторые солончаки. Щелочность вызывается различными солями: карбонатами, фосфатами, боратами, гуматами, силикатами. Но главную роль играют Na2CO3 и CaCO3 , последний создает кислотно-основную буферность и сравнительно высокую щелочность. Регулирование реакции осуществляется в этом случае за счет карбонатно-кальциевой системы. Карбонат кальция присутствует в твердой части почвы, вода в почве имеется почти всегда (за исключением сильных засух), а CO2 всегда есть в почвенном воздухе. Эта система работает до тех пор, пока в твердой части почвы присутствует CaCO3 , и обусловливает величины рН почвенных суспензий до 7,5 — 10,0 в зависимости от парциального давления CO2 в почвенном воздухе.
Щелочность почв неблагоприятно сказывается на их химических и физических свойствах. Под действием щелочной среды почвы расплываются, теряют структурность, а затем при высыхании сливаются в плотные, очень прочные глыбы, которые часто не поддаются действию плуга. Таковы солонцы в зонах черноземных, каштановых и бурых почв.
Устраняют потенциальную кислотность довольно простыми приемами. Обычно к почве добавляют карбонат кальция (известь), который нейтрализует различные формы кислотности.
Природная кислотность почв может быть вызвана органическими кислотами, попадающими в почву с растительными остатками или корневыми выделениями, диоксидом углерода в почвенном воздухе и поступлением азотной и серной кислот с кислыми дождями. Анализ химических равновесий показал, что роль CO2 в этом процессе более значительна, чем это представлялось раньше. Растворение CO2 приводит к образованию угольной кислоты h3CO3 .
Для улучшения кислых почв служит извескование, в его составе лежит обменная кислотность. Для точной потребности почв в известковании необходимо знать рН обменную: меньше 4,5 — сильнокислые; 4,6-5 – кислые-нуждаются; 5,1-5,5 – слабо-кислые – средненуждаются; 5,6 -6,0 – не кислые – слабо нуждаются; 6,0 – близкие к нейтральным – не нуждаются. По гидролитич. кислотности рассчит. дозу извести. Влияние извести на плодородие. 1. Нейтрализ. орган к-ты, устран кислотности. 2 Улучшаются услов. для гумификац. и образован структуры почвы, водно-возд и тепловой режимы, азотное пит, т.к. ↑ кол-во и активность микроорган. 3. При известковании, когда вносится Са, труднорастворим. фосфаты Аl и Fe переходят в фосфаты Са, кот лучше доступны растен. 4. Возростает эффективность физиологич. кислых удобрений. Использ: тв породы известняка, мела, отходы промышленности (сланцевые золы).
Буферность почв — способность почв сохранять свои основные характеристики при различных внешних воздействиях.
Кисло́тно-осно́вная бу́ферность по́чвы — способность жидкой и твердой фаз почвы противостоять изменению реакции среды (pH) при взаимодействии почвы с кислотой или щелочью или при разбавлении почвенной суспензии.
Буферность почвы,
свойство почвы препятствовать изменению её реакции (pH) под действием кислот и щелочей. Чем больше в почвенном растворе солей сильных оснований и слабых кислот, тем более буферна почва по отношению к кислым удобрениям; соли слабых оснований и сильных кислот буферны к щелочным удобрениям. Так как раствор находится в постоянном взаимодействии с твёрдой фазой почвы, то последняя также оказывает существенное влияние на буферность. Чем больше коллоидных частиц и гумуса в почве (например, чернозёмы) и чем больше они содержат поглощённых оснований, тем буфернее почва по отношению к кислым удобрениям; поглощённый коллоидами водород (подзолистые почвы, краснозёмы) способствует увеличению Б. п. к щелочным удобрениям. Наиболее буферны почвы тяжёлого (глинистого) механического состава. Атмосферные осадки, грунтовая и оросительная вода могут изменить реакцию почвы, если последняя не обладает буферностью, и наоборот. Растения реагируют на изменение реакции почвы, поэтому Б. п. играет большую роль в их росте и развитии. Б. п. можно повысить внесением органических удобрений.
Понятие о структурности и структуре почвы. Виды структуры почвы. Основные показатели структуры почвы. Агрономически ценные виды структуры почвы. Мероприятия по созданию и поддержанию агрономически ценной структуры почвы.
Структура почвы – совокупность почвенных агрегатов, различных размеров, формы и качества.
Структурность почвы – способность почвы распадаться на агрегаты.
Агрегаты – это группа элементов почвенных частиц, которые соединяются друг с другом прочнее чем с другими соседними почвенными частицами.
В природе крайне редко встречаются бесструктурные почвы, почвы песчаные по гранулометрическому составу. Бесструктурные, массивные – глины.
Классификация структуры- разделение агрегатов на группы по размерам и форме.
По форме: — клубовидная, — призмовидная, — плитовидная.
По размеру: — микроагрегаты (<0,25мм), — макроагрегаты (>0,25мм).
— Макроагрегаты: — глыбы (>10 мм), — пыль (< 0,25 мм), — агрономически ценные (0,25 – 10 мм) – это агрегаты, которые обеспечивают оптимальное содержание в почве одновременно воздуха и воды.
По качеству: — по порозности, — мех.прочности, — водопрочности.
Виды структуры почвы
Структурой почвы называют отдельности более или менее четкой геометрической формы, на которые распадается почва, без применения какого-либо значительного механического воздействия. Форма структурных отдельностей зависит от свойств почвы, определяемых механическим составом и почвообразовательным процессом. Различают следующие главнейшие виды почвенной структуры.
Зернистая структура почвы. Структурные отдельности более или менее ясно ограниченной формы с шероховатой поверхностью диаметром 0,5-5,0 мм. Эта структура, присущая почвам со значительным содержанием перегноя, образуется при воздействии корневой системы травянистой растительности. Имеются указания на большую роль дождевых червей в ее образовании. Как переходная форма встречается зернистая структура с острореберной поверхностью. По виду она напоминает зерно гречихи (отсюда начтите «крупитчатая»).
Комковатая структура. Отличается от зернистой большим разбором и меньшей прочностью. Имеет неправильную округлую корму с относительно шероховатой поверхностью. Различают мелко-комковатую структуру с диаметром 0,5-3,0 см и крупно-комковатую с диаметром 3-5 см.
Глыбистая структура. Структурные отдельности неправильной формы размером в поперечнике от 5 до 10 см и больше.
Сложение почв
Слагающие почву механические элементы и структурные отдельности прилегают друг к другу различным образом, создавая пустоты, или поры, разного размера и формы. Различают пористое, ноздреватое, трещиноватое сложение. Важное значение имеет плотность сложения, которая обусловлена характером прилегания механических элементов и структурных отдельностей друг к другу. Различают следующие градации плотности сложения.
Рыхлое сложение. Механические элементы настолько мало сцеплены, что при рытье почвенного разреза его стенки осыпаются. Такое сложение имеют некоторые пески.
Рыхловатое сложение. Сцепление большее. При рытье почвенного разреза стенки не осыпаются. Нож в стенку разреза входит легко, но если его вынуть, то наблюдается осыпание почвы. Подобное сложение имеет место в песчаных почвах, а также в глинистых и суглинистых с мелкокомковатой (пороховидной) структурой.
Плотноватое сложение. Лопата сравнительно легко входит в почву. При выбрасывании почва рассыпается на составляющие ее структурные отдельности. Наблюдается в глинистых и суглинистых почвах с хорошо выраженной зернистой, пластинчатой или ореховатой структурой, а также в супесях и некоторых сцементированных песках.
Плотное сложение. Частицы настолько плотно прилегают друг к другу, что лопата с трудом входит в почву. Подобное сложение присуще нижним горизонтам почв с призматической структурой, а также солонцеватым почвам.
Очень плотное сложение. При копке почвенного разреза приходится прибегать к лому или кирке. Наблюдается в уплотненных горизонтах солонцов и сильносолонцеватых почв, а также в сливных почвах.
Каждому типу почв и каждому генетическому горизонту свойственны определенные типы почвенных структур. Для гумусовых горизонтов, например, характерна зернистая, комковато-зернистая, порошисто-комковатая структура; для элювиальных горизонтов — плитчатая, листоватая, чешуйчатая, пластинчатая; для иллювиальных — столбчатая, призматическая, ореховатая, глыбистая и т. д.
Если структура неоднородна, то для ее характеристики пользуются двойными названиями (комковато-зернистая, ореховато-призматическая и т. д.), последним словом указывая преобладающий вид структуры.
При изменении характера распределения структурных элементов внутри горизонта в почвенном дневнике обязательно отмечается это различие.
Большое значение для агрономической характеристики почвы имеет водопрочность ее структуры, т. е. образование прочных, неразмываемых в воде отдельностей. Такая структура образуется в результате скрепления механических элементов органоминеральными коллоидами, скоагулированными необратимо. Почвы, обладающие водопрочной структурой, имеют благоприятный для развития растений водно-воздушный режим, хорошие механические свойства и т. д. Почвы, не имеющие водопрочной структуры, быстро заплывают, становятся непроницаемыми для воды и воздуха, а при высыхании растрескиваются на крупные глыбы. Водопрочность структуры (в почвах, насыщенных водой) должна отражаться в почвенном дневнике.
Рекомендуемые страницы:

 HS– +
OH–
HS– +
OH–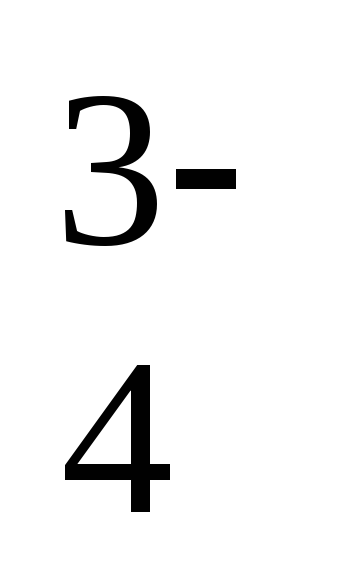 + Н2О
+ Н2О HPO
HPO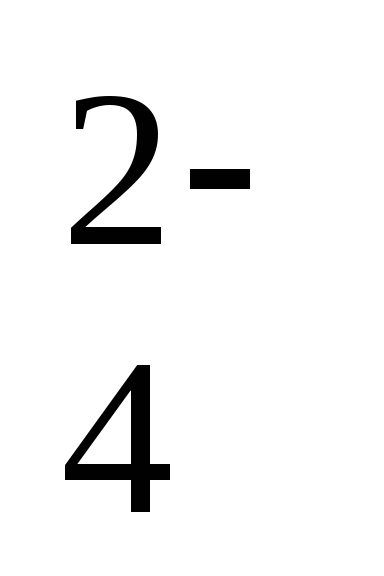 +
OH–
+
OH–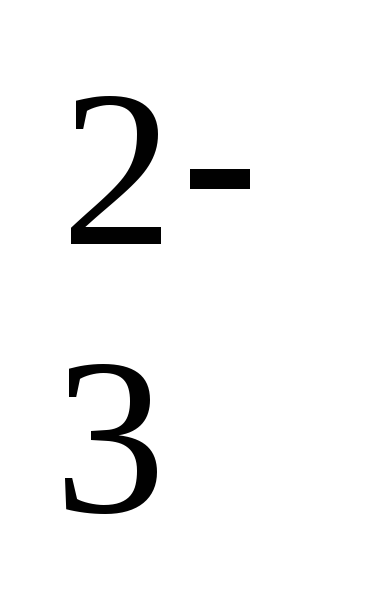 +Н2О
+Н2О HCO
HCO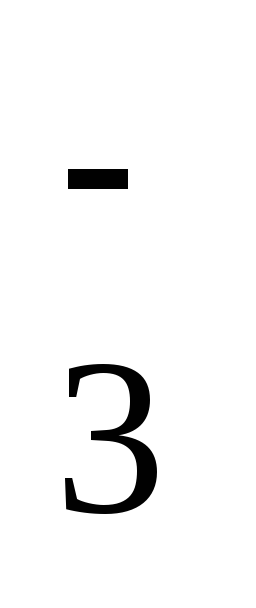 +
OH–
+
OH–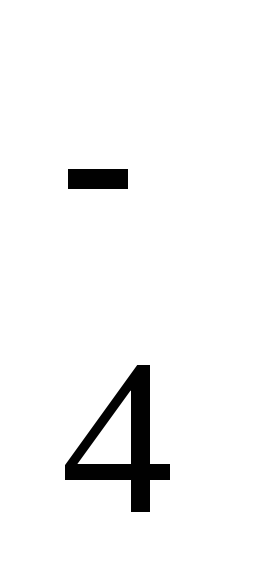 +Н2О
+Н2О H4SiO4+ OH–
H4SiO4+ OH– +
Н2O
+
Н2O Н2ВО3 + ОН–
Н2ВО3 + ОН– + Н2O
+ Н2O Н2РО
Н2РО + ОН–
+ ОН– + Н2О
+ Н2О Н2СО3 + ОН–
Н2СО3 + ОН– Н2S
+ ОН–
Н2S
+ ОН–