Медный купорос в домашних условиях
Из всех химических соединений, которые применяют в каждом хозяйстве, наверно, наиболее популярным является вещество — медный купорос. Фактически – это кристаллогидрат сульфата меди или сернокислой меди. Медный купорос ядовит для человека и животных, однако не теряет своей популярности в промышленной и сельскохозяйственной отраслях. В этой статье мы рассмотрим, что такое медный купорос, применение его в различных целях, а также как сделать медный купорос дома.
Состав медного купороса представлен 5-водным сульфатом 2-валентной меди CuSO4х5H2O. Это гигроскопичный кристаллический порошок голубого или синего оттенка. Продается он расфасованный по 50-100 г в пакетах или флаконах.
Получение медного купороса
Производство медного купороса в промышленных масштабах происходит следующими методами:
- растворение Cu и медных отходов в разбавленной h3SO4, в условиях продувания воздуха
- растворение CuO в H2SO4
- сульфатизирующий обжиг сульфидов Cu
- в качестве побочного продукта электролитического рафинирования Cu.
- CuO + H2SO4→ CuSO4 + H2O
- 2Cu + O2 + 2H2SO4→ 2CuSO4 + 2H2O
Медный купорос в домашних условиях можно получить вследствие реакции с концентрированной серной кислотой в условиях повышенной температуры:
- Cu + 2H2SO4→ CuSO4 + SO2↑ + 2H2O
Однако, показатель температуры не должен превышать 60 градусов Цельсия, поскольку при более высокой температуре образуется побочный продукт:
- 5Cu + 4H2SO4→ 3CuSO4 + Cu2S + 2H2O.
Использование в рыбоводных хозяйствах
Медный купорос широко применяют в качестве профилактического средства инфекционных и инвазионных заболеваний рыб. К примеру, медный купорос применяют для дезинфекции орудий лова рыбы таких как, невод, бредни, сети, сачки. Их необходимо хорошо промыть от ила и рыбьей слизи, очистить от травы и прочих загрязнений. После этого, тщательно высушить. Все орудия из хлопка, льна и капрона нужно продержать 2 часа в 0,5%-ном растворе медного купороса, после чего хорошо прополоснуть водой.
Обработка должна проводиться сразу по окончанию выращивания рыб и спуска воды.
Применение в гальванопластике.
Медь является наиболее востребованным металлом в гальванотехнике. Как известно покрытие из меди является мягким, достаточно пластичным, а также отлично паяется. Отметим еще, что медь отлично проводит электричество. Однако, несмотря на такие качества, как окончательное покрытие медь применяют крайне редко, поскольку она быстро окисляется под действием кислорода воздуха и тускнеет.
Великолепные выравнивающие и кроющие качества меди сделали ее идеальным вариантом для применения в качестве подложки до нанесения других металлов. Кроме этого, вследствие повышенной мягкости и пластичности, медь легко отполировать до яркого блеска, что дает возможность получить на ней такой же яркий и блестящий слой любого другого металла.
Медный купорос в системе оборотного водоснабжения
Любое промышленное производство имеет в наличии теплотехнические агрегаты и механизмы. Их правильную работу обеспечивает качественный отвод тепла. К примеру, компрессоры сжатого воздуха, основные металлоконструкции в плавильных и нагревательных печах. Система оборотного водоснабжения нужна на любом предприятии, ведь она осуществляет необходимое охлаждение всех теплообменных аппаратов, машин и агрегатов.
Во время использования водозаборных колодцев и сеточных камер их стенки обрастают дрейсеной, балянусом, также мидиями. Обработка таких конструкций проводится при помощи медного купороса. Растворение 1-1,5 мл медного купороса в литре воды позволяет получить высококачественный раствор для дезинфекции. Обработка должна проводиться каждый двое суток.
Защита деревянных конструкций
Способность медного купороса подавлять развитие и размножение плесени и грибков нашла применение в обработке деревянных конструкциях, которые длительно подвергаются действию воды.
К примеру, медный купорос в паре бихроматом с натрия является отличным средством для обработки деревянных конструкций речных мостов. Вследствие такой обработки увеличивается период эксплуатации моста. Этот метод используют в регионах, где древесина является местным строительным материалом.
Чтобы ускорить сроки пропитки древесины обработка проводится в условиях высокого давления с использованием специальной техники. Состав для пропитки готовят по-разному. Однако наиболее оптимальным является вариант, при котором медного купороса и бихромата натрия используется равное количество.
Лечение фасциолеза и лишая
В животноводческой отрасли медным купоросом пользуются для борьбы с болезнью фасциолез, которую иначе называют «печеночные клопы». Фасциолезом болеют овцы, козы, крупный рогатый скот, свиньи, лошади, лоси, зубры, косули. Также это заболевание может развиваться и у человека.
Зараженный фасциолами молодняк крупного рогатого скота имеет среднесуточный привес на 10,4—11,2% меньше в сравнении со здоровыми животными. Объем молока от больных коров может снижаться на 10-50% такое молоко менее жирное, в нем меньше белка и витаминов.
Более 60 лет ведутся исследования по изучению гельминтофауны животных и разработка мероприятий, которые направлены на борьбу с этим заболеванием.
Промежуточным хозяином для фасциолы является малый прудовик. Наилучшим образом в борьбе с этим моллюском себя зарекомендовали известь и медный купорос.
Раствор медного купороса в концентрации 1:50 000 приводит к гибели всех прудовиков за сутки часа. Если концентрацию раствора повысить 1:100 000, то моллюски погибнут через 1 час.
Наиболее восприимчивыми являются лошади и коровы. От животных может заразиться человек.
Для лечения больных животных используют 20%-ный раствор медного купороса, разведенного в нашатырном спирте, которым обрабатывают животных. Кроме этого, растворы медного купороса используют для лечения еще многих заболеваний грибкового характера.
Демеркуризация медным купоросом
Медный купорос применяют согласно правилам Министерства Чрезвычайных Ситуаций для мероприятий, по устранению последствий проливов металлической ртути. С целью обезвреживания ртути применяют 10 % водный раствор медного купороса, то есть 100 г медного купороса растворяют в 900 г воды. Всю площадь заражения покрывают 10 % водным раствором сульфата меди в количестве 0,1-0,15 л/м2. Через 1 — 2 минуты сверху наносят 10% раствор йодистого калия в количестве 0,2 -0,3 л/м2.
После проведения обработки на поверхности формируется йодид меди, взаимодействующий со ртутью таким образом, что можно визуально выявить области скопления ртути. Чистая поверхность будет окрашена в бледно – розовый цвет. Тогда как, поверхность в местах скопления ртути станет красно — бурого цвета.
Если ртуть была разлита на линолеум, плитку, гранит, железобетон, достаточно одного раза обработки. Заключительный этап обработки включает проведение тщательной уборки.
Извлечение золота из бедных руд
Вследствие непрекращающегося роста объемов добычи золота за последние несколько десятилетий, образовалось колоссальное количество отходов. Такие отходы представляют собой отвалы и хвостохранилища. Как известно, в них также находится определенное количество ценных минералов, относимых к категории неизбежных потерь, которые возникают по причине несовершенства техники и технологий.
- кристаллический медный купорос
- ксантоген
- каптакс.
Количество каждого из этих веществ подбирается на основании состава сырья. Расход составляет от 40 до 100 грамм медного купороса на тонну сырья.
При количестве 0,3 г/т в техногенном сырье, после обработки медным купоросом концентрация составляет 7г/т. А с таким составом уже можно работать по традиционной технологической схеме и извлекать дополнительные объемы золота.
Медный купорос, применение в садоводстве
В качестве удобрения вносят сульфат меди 1 раз в 5-6 лет в весеннее время в количестве 1 г/1 м2. Перед внесением его необходимо тщательно измельчить и перемешать с землей.
Ранней весной плодовые деревья и кустарники опрыскивают раствором медного купороса в концентрации 100 г медного купороса на 10 л воды. Корни саженцев плодовых и цветковых растений в целях дезинфекции обрабатывают таким же раствором. Это помогает бороться со следующими заболеваниями:
- антракноз
- мучнистая американская роса
- серая, белая гниль.
Перед посадкой можно обработать клубни картофеля против фитофтороза.
Чтобы повысить выход посадочного материала, а также его устойчивость к неблагоприятным факторам внешней среды проводят предпосевную обработку семян: ели европейской. Для этого используют раствор 0,005-0,02%. раствора должно быть в 3-4 раза больше, чем семян. Семена нужно замочить в нем на 12 — 18 ч. После обработки семена подсушивают на воздухе в тени и сразу высевают.
Медный купорос — красивое и полезное неорганическое соединение
Медный купорос — это кристаллогидрат соли CuSO4. Вещество активно поглощает влагу из материалов, с которыми контактирует, после растворения в воде и кристаллизуется в виде пентагидрата сульфата меди (II) CuSO4•5h3O.
Свойства
Медь сернокислая 5-водная представляет собой ярко-синие кристаллы  триклинной формы. Сине-бирюзовый порошок на воздухе постепенно выветривается, теряя молекулы воды, и становится сначала зеленовато-голубым, потом бесцветным — превращается в чистый сульфат меди. Тоже самое происходит при нагревании: водная соль постепенно становится безводной. Обе соли не имеют запаха, непрозрачны, вкус неприятный, горьковатый, с металлическим оттенком.
триклинной формы. Сине-бирюзовый порошок на воздухе постепенно выветривается, теряя молекулы воды, и становится сначала зеленовато-голубым, потом бесцветным — превращается в чистый сульфат меди. Тоже самое происходит при нагревании: водная соль постепенно становится безводной. Обе соли не имеют запаха, непрозрачны, вкус неприятный, горьковатый, с металлическим оттенком.
CuSO4•5h3O растворяется в разбавленном спирте, в чистом — не растворяется. Растворяется в концентрированной соляной кислоте. Медный купорос не горит, считается взрывобезопасным, но при нагревании в закрытой емкости может взрываться, т.к. разложение соли связано с выделением газов. Именно поэтому хранить большие количества вещества следует в проветриваемом помещении.
Пентагидрат сульфата меди (II) — вещество второго класса опасности, не очень токсичное. Может вызывать неприятные симптомы, если его вдохнуть или проглотить определенную дозу (народная медицина располагает рецептами, в которых нужно пить раствор медного купороса). Также следует беречь глаза от мелкодисперсионной пыли сульфата меди. Передозировка вызывает сердцебиение, рвоту, боли в животе, удушье, вплоть до потери сознания. Поэтому к рецептам нетрадиционной медицины следует подходить критично, с осторожностью.
Длительно работать с веществом следует в защитной одежде, защищая глаза, кожу и дыхание спецсредствами (перчатки, комбинезон, респиратор, защитные очки).
Получение медного купороса
 В природе встречается различные модификации сульфата меди (II): халькантит (медный купорос), халькокианит (безводный сульфат меди), бонаттит (трехводная соль), бутит (7-водная соль), брошантит (CuSO4•3Сu(ОН)2).
В природе встречается различные модификации сульфата меди (II): халькантит (медный купорос), халькокианит (безводный сульфат меди), бонаттит (трехводная соль), бутит (7-водная соль), брошантит (CuSO4•3Сu(ОН)2).
В промышленных масштабах медный купорос получают химическими способами из меди или оксида меди и серной кислоты или из отходов процесса электролитической очистки меди. Большая часть добываемого и производимого химического реактива расходуется на получение разнообразных соединений меди.
Применение
— В химической индустрии при изготовлении красок и лаков.
— При обогащении руды.
— Гальваническое и электролитическое покрытие металлов медью.
— Электроника: изготовление печатных плат.
— Фотография: для тонирования отпечатков.
— Текстильная индустрия: получение ацетатного волокна; протравливание тканей.
— В строительстве: защита древесины от гниения, бетона, штукатурки, кирпичной кладки — от солевых отложений, металла — от ржавчины.
— В пищевой промышленности 5-водная сернокислая медь — пищевая  добавка Е519. Применяются ее антисептические и влагопоглощающие свойства (консервант, загуститель).
добавка Е519. Применяются ее антисептические и влагопоглощающие свойства (консервант, загуститель).
— Медицина и ветеринария: обеззараживающее вещество и противогрибковое средство.
— Растениеводство: препараты от болезней растений, медесодержащие удобрения; составы для лечения повреждений плодовых деревьев; средства для протравливания семян.
В интернет-магазине Prime Chemicals Group медный купорос и другие химические реактивы, а также лабораторное оборудование купить можно по доступным ценам и с доставкой по Москве и Московской области.
как сделать медный купорос в домашних условиях
Делать медный купорос в домашних условиях не рекомендуется. Работать нужно с серной кислотой при нагревании, нужен вытяжной шкаф. В общем, очень трудоемкое и опасное задание. Медный купорос получают в промышленности: растворением Cu и медных отходов в разб. h3SO4 при продувании воздуха; растворением CuO в h3SO4; сульфатизирующим обжигом сульфидов Cu; как побочный продукт электролитич. рафинирования Cu. CuO + h3SO4→ CuSO4 + h3O 2Cu + O2 + 2h3SO4→ 2CuSO4 + 2h3O В лаборатории можно получить действием концентрированной серной кислотой на медь при нагревании: Cu + 2h3SO4→ CuSO4 + SO2↑ + 2h3O Температура не должна превышать 60 градусов Цельсия так как образуется побочный продукт: 5Cu + 4h3SO4→ 3CuSO4 + Cu2S + 2h3O Зато в домашних условиях можно вырастить кристалл медного купороса. <img src=»//otvet.imgsmail.ru/download/56d1b2023e5e62272a8ad354f5209d62_i-1268.jpg» > <a rel=»nofollow» href=»http://klol.ru/ourfamily/58-child-parrents/64-growsrystal» target=»_blank» >Выращивание кристаллов в домашних условиях из медного купороса </a>
если нет серной кислоты а интересно эти заняться медный купорос свободно продается в магазине как средство защиты растений от болезней и для приготовления бордосской жидкости еще можно попытаться заняться гальваникой даже выращивать кристаллики меди
Медь — Википедия
| Медь | |
|---|---|
| ← Никель | Цинк → | |
| пластичный металл красно-розового цвета | |
 Самородная медь | |
| Название, символ, номер | Медь/Cuprum (Cu), 29 |
| Атомная масса (молярная масса) | 63,546(3)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d10 4s1 |
| Радиус атома | 128 пм |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+2e) 73 (+1e) 77 (K=6) пм |
| Электроотрицательность | 1,90 (шкала Полинга) |
| Электродный потенциал | +0,337 В/ +0,521 В |
| Степени окисления | 3, 2, 1, 0 |
| Энергия ионизации (первый электрон) | 745,0 (7,72) кДж/моль (эВ) |
| Плотность (при н. у.) | 8,92 г/см³ |
| Температура плавления | 1356,55 K (1083,4 °С) |
| Температура кипения | 2567 °С |
| Уд. теплота плавления | 13,01 кДж/моль |
| Уд. теплота испарения | 304,6 кДж/моль |
| Молярная теплоёмкость | 24,44[2] Дж/(K·моль) |
| Молярный объём | 7,1 см³/моль |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 3,615 Å |
| Температура Дебая | 315 K |
| Теплопроводность | (300 K) 401 Вт/(м·К) |
| Номер CAS | 7440-50-8 |
Медь (Cu от лат. Cuprum) — элемент одиннадцатой группы четвёртого периода (побочной подгруппы первой группы) периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко используется человеком.
Медь — один из первых металлов, хорошо освоенных человеком из-за доступности для получения из руды и малой температуры плавления. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк[3]. Медный век, когда значительное распространение получили медные предметы, следует во всемирной истории за каменным веком. Экспериментальные исследования С. А. Семёнова с сотрудниками показали, что, несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий[4].
В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришёл на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. На смену бронзовому веку относительно орудий труда пришёл железный век.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
- 2CO+(CuOH)2CO3→2Cu+3CO2+h3O{\displaystyle {\mathsf {2CO+(CuOH)_{2}CO_{3}\rightarrow 2Cu+3CO_{2}+H_{2}O}}}
На Кипре уже в 3 тысячелетии до нашей эры существовали медные рудники и производилась выплавка меди.
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, в Сибири, на Алтае, на территории Украины.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи) (752 г.).
С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике[5].
Латинское название меди Cuprum (древнелат. aes cuprium, aes cyprium) произошло от названия острова Кипр, где было богатое месторождение.
У Страбона медь именуется χαλκός, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди aes (санскр. ayas, готск. aiz, нем. erz, англ. ore) означает руда или рудник.
Слова медь и медный встречаются в древнейших русских литературных памятниках: ст.‑слав. *mědь «медь» не имеет чёткой этимологии, возможно, исконное слово[6][7]. В. И. Абаев предполагал происхождение слова от названия страны Мидия: *Мѣдь из ир. Мādа — через посредство греч. Μηδία[8]. Согласно этимологии М. Фасмера, слово «медь» родственно др-герм. smid «кузнец», smîdа «металл»[8].
Медь обозначалась алхимическим символом «♀» — «зеркало Венеры», и иногда сама медь именовалась алхимиками тоже как «венера». Это связано с тем, что богиня красоты Венера (Афродита), являлась богиней Кипра[9], и из меди делались зеркала. Этот символ Венеры также был изображён на брэнде Полевского медеплавильного завода, им с 1735 по 1759 годы клеймилась полевская медь, и изображён на современном гербе города Полевской[9][10]. С Гумёшевским рудником Полевского, — крупнейшим в XVIII−XIX веках месторождением медных руд Российской империи на Среднем Урале, — связан известный персонаж сказов П. П. Бажова — Хозяйка медной горы, покровительница добычи малахита и меди. По одной из гипотез, она является преломлённым народным сознанием образом богини Венеры[9].
 Самородная медь
Самородная медьСреднее содержание меди в земной коре (кларк) — (4,7—5,5)·10−3% (по массе)[2]. В морской и речной воде содержание меди гораздо меньше: 3·10−7 % и 10−7 % (по массе) соответственно[2].
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн[11]. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Жезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси)[12].
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
 Кристаллы меди
Кристаллы медиМедь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло-[13] и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5—58 МСм/м[14]. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
Атомная плотность меди (N0) = 8,52⋅1028{\displaystyle 8,52\cdot 10^{28}} (атом/м³).
Изотопы меди[править | править код]
Природная медь состоит из двух стабильных изотопов — 63Cu (изотопная распространённость 69,1 %) и 65Cu (30,9 %). Известны более двух десятков нестабильных изотопов, самый долгоживущий из которых 67Cu с периодом полураспада 62 часа[15].
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз.
Пирометаллургический метод[править | править код]
- Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Халькопиритное сырьё содержит 0,5—2,0 % Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400 °C :
- 2CuFeS2+O2⟶Cu2S+2FeS+SO2↑{\displaystyle {\mathsf {2CuFeS_{2}+O_{2}\longrightarrow Cu_{2}S+2FeS+SO_{2}\uparrow }}}
- 2FeS+3O2⟶2FeO+2SO2↑{\displaystyle {\mathsf {2FeS+3O_{2}\longrightarrow 2FeO+2SO_{2}\uparrow }}}
Затем обожжённый концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезём:
- FeO+SiO2⟶FeSiO3{\displaystyle {\mathsf {FeO+SiO_{2}\longrightarrow FeSiO_{3}}}}
Образующийся силикат в виде шлака всплывает, и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезёма выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической (черновой) меди:
- 2Cu2S+3O2⟶2Cu2O+2SO2{\displaystyle {\mathsf {2Cu_{2}S+3O_{2}\longrightarrow 2Cu_{2}O+2SO_{2}}}}
- 2Cu2O+Cu2S⟶6Cu+SO2{\displaystyle {\mathsf {2Cu_{2}O+Cu_{2}S\longrightarrow 6Cu+SO_{2}}}}
Получаемая металлическая (черновая) медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкислённого раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
- CuO+h3↑⟶Cu+h3O+Q↑{\displaystyle {\mathsf {CuO+H_{2}\uparrow \longrightarrow Cu+H_{2}O+Q\uparrow }}}
Гидрометаллургический метод[править | править код]
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом:
- CuSO4+Fe⟶Cu↓+FeSO4{\displaystyle {\mathsf {CuSO_{4}+Fe\longrightarrow Cu\downarrow +FeSO_{4}}}}
Электролизный метод[править | править код]
Электролиз раствора сульфата меди:
- CuSO4⇄Cu2++SO42−{\displaystyle {\mathsf {CuSO_{4}\rightleftarrows Cu^{2+}+SO_{4}^{2-}}}}
- K−:Cu2++2e⟶Cu0{\displaystyle {\mathsf {K^{-}:Cu^{2+}+2e\longrightarrow Cu^{0}}}}
- A+:2h3O−4e⟶O2+4H+{\displaystyle {\mathsf {A^{+}:2H_{2}O-4e\longrightarrow O_{2}+4H^{+}}}}
- 2CuSO4+2h3O⟶2Cu↓+O2↑+2h3SO4{\displaystyle {\mathsf {2CuSO_{4}+2H_{2}O\longrightarrow 2Cu\downarrow +O_{2}\uparrow +2H_{2}SO_{4}}}}
Возможные степени окисления[править | править код]
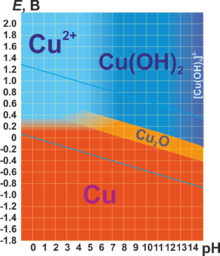
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например, [Cu(NH3)2]+). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях и комплексах можно получить соединения со степенью окисления +3, +4 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году.
Простое вещество[править | править код]
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не вступает в реакцию с водой и разбавленной соляной кислотой. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Вступает в реакцию при нагревании с галогеноводородами.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
- 2Cu+h3O+CO2+O2⟶ (CuOH)2CO3↓{\displaystyle {\mathsf {2Cu+H_{2}O+CO_{2}+O_{2}\longrightarrow \ (CuOH)_{2}CO_{3}\downarrow }}}
Реагирует с концентрированной холодной серной кислотой:
- Cu+h3SO4⟶ CuO+SO2↑ +h3O{\displaystyle {\mathsf {Cu+H_{2}SO_{4}\longrightarrow \ CuO+SO_{2}\uparrow \ +H_{2}O}}}
С концентрированной горячей серной кислотой:
- Cu+2h3SO4⟶ CuSO4+SO2↑ +2h3O{\displaystyle {\mathsf {Cu+2H_{2}SO_{4}\longrightarrow \ CuSO_{4}+SO_{2}\uparrow \ +2H_{2}O}}}
С безводной горячей серной кислотой:
- 2Cu+2h3SO4 →200oC Cu2SO4↓+SO2↑ +2h3O{\displaystyle {\mathsf {2Cu+2H_{2}SO_{4}\ {\xrightarrow {200^{o}C}}\ Cu_{2}SO_{4}\downarrow +SO_{2}\uparrow \ +2H_{2}O}}}
C разбавленной серной кислотой при нагревании в присутствии кислорода воздуха:
