Внимание! Золотистая картофельная нематода / Россельхознадзор
На территории Томской области в 2013 году установлено 38 карантинных фитосанитарных зон по Золотистой картофельной нематоде (Globodera rostochiensis Woll — карантинный вредный организм. В связи с широким распространением в Томской области данного карантинного вредителя Управление Россельхознадзора по Томской области напоминает:
Золотистая картофельная нематода относится к группе микроскопических круглых червей — нематод. Это опасный возбудитель заболевания картофеля и томатов. Пораженные растения отстают в росте, листья приобретают бледную окраску, скручиваются и постепенно увядают. В местах, где большая степень заражения нематодой появляется очаги с угнетенными, желтыми, сильно отстающими в росте растениями. Что приводит к значительному снижению урожая. При сильном поражении, растения, чтобы получить питательные вещества и воду, образуют мелкие корни, так называемую «бородатость» корневой системы.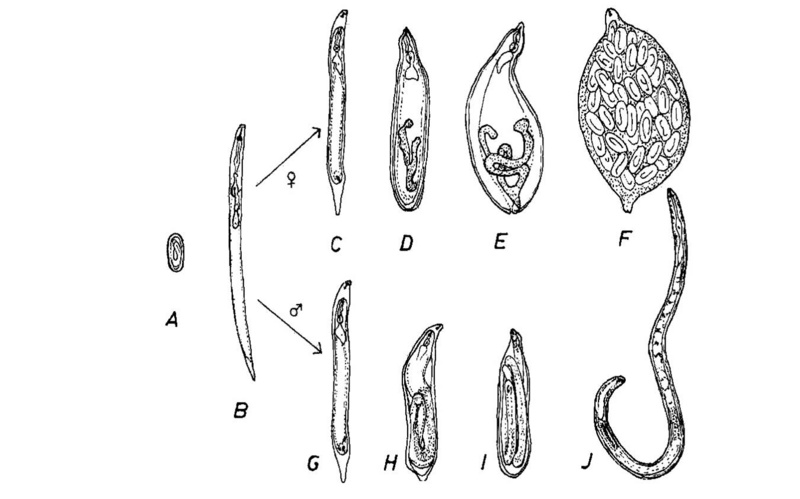
С середины июля на корнях картофеля можно заметить мелких, размером с маковое зерно, округлых форм гельминтов (микроскопические черви). Они могут быть белого, желтого или золотистого цвета, а, превращаясь в цисты (отмершие самки с жизнеспособным содержимым внутри – яйцами и личинками), становятся коричневыми или темно-бурыми. Осенью цисты отделяются от корней в почву, где и зимуют. В таком состоянии цисты без растения-хозяина способны сохраняться до 8 лет. Весной из одной самки выходит до 200 личинок, которые начинают активно питаться соками растений. Очаг заражения с каждым годом расширяется. Распространяется нематода преимущественно с частицами почвы на семенном материале, инвентаре, обуви, талыми водами.
Меры борьбы с вредителем:
— Выращивать устойчивые к нематоде сорта картофеля.
— Чередовать картофель с такими сельскохозяйственными культурами как капустой, укропом, морковью, редисом, горохом, клевером, многолетними травами.
— Восприимчивые сорта картофеля не следует выращивать на одном участке 4 -5 лет.
— Уничтожать сорняки, особенно из семейства паслёновые.
— При обнаружении зараженных растений, их желательно удалить с поля и сжечь. Осенью при уборке картофеля необходимо удалить ботву с участка и сжечь.
— Применение органических удобрений (навоз, куриный помет) несколько снижает численность паразита и поддерживает жизнедеятельность растений.
— После работы на зараженном участке, чтобы не распространять нематоду, необходимо проводить очистку и дезинфекцию обуви и сельскохозяйственного инвентаря. Очень важно вовремя обнаружить картофельную нематоду и не допустить ее дальнейшего распространения.
В случае выявления признаков заражения золотистой картофельной нематодой обращаться в Управление Россельхознадзора по Томской области по тел. 44-46-36, 26-22-24.
Источник: Управление Федеральной службы по ветеринарному и фитосанитарному надзору по Томской области
Внимание: нематода
Внимание: нематода
06. 12.2019
16:00
1369
0
12.2019
16:00
1369
0
Картофельная нематода является карантинным вредителем во многих регионах страны. И, приобретая посадочный материал, выращенный за пределами республики, садоводы-огородники должны об этом помнить.
Золотистая нематода развивается только на корневой системе растений семейства пасленовых, в том числе и картофеле, сильно угнетая растение, а то и приводя его к гибели. Наибольший вред от нематоды ощущается на участках сокращенного севооборота, потери урожая могут достигать 80%.
Определить, заражен ли участок картофельной нематодой, без проведения анализа невозможно. Поэтому первые признаки присутствия нематоды проявляются непосредственно на растении. Если через 45–50 дней после посадки картофеля, растения имеют длинные и тонкие стебли, пожелтевшие нижние листья, ветвистую корневую систему коричневого цвета без клубней и на ней видны золотистые шарики (цисты), то это значит, что на вашем участке орудует нематода.
Наряду со снижением урожая, нематоды способствуют распространению болезней. Стеблевая нематода поражает все части растений, отдает предпочтение ранним сортам. Вызывает утолщение стеблей с одновременным укорачиванием междоузлий, образование мелких бледно-зеленых листьев с волнистыми краями. Во время хранения пораженных клубней на их поверхности образуются серые пятна. В дальнейшем кожура разрывается в местах поражения. Мякоть клубня представляет собой трухлявую массу коричневого цвета.
Полный цикл развития нематоды проходит в корневой системе картофеля. При наступлении благоприятных условий из цист выходят личинки. Они отлично чувствуют корневые выделения и поэтому быстро находят хозяина. Личинки могут жить в цистах до десяти лет. Проникая в корневую систему, они начинают питаться содержимым клеток. Самки образуют яйца и сохраняют их в своем теле. Количество яиц зависит от обеспеченности самки питанием и колеблется в пределах нескольких сотен. После откладывания яиц, самки отмирают, их тело затвердевает и становится коричневым (цисты). В конце вегетационного периода цисты отпадают от корневой системы и остаются в почве, где и зимуют.
В конце вегетационного периода цисты отпадают от корневой системы и остаются в почве, где и зимуют.
Методы борьбы с картофельной нематодой направлены на предупреждение заражения почвы. Вся система включает в себя следующий комплекс мероприятий: соблюдение севооборота. Возвращение растений семейства пасленовых не ранее, чем через 4–5 лет. Обязательная глубокая обработка почвы осенью. Использовать для посадки только проверенный семенной материал. Клубни картофеля с зараженных участков использовать только на переработку или корм скоту. Выращивание устойчивых сортов к нематоде (Приора, Лукъяновский, Кристалл и так далее), а также супер ранние сорта (Жуковский ранний). Зараженные кусты следует выкопать и вместе с землей унести с поля. Использование отдельного инвентаря для зараженных участков. Применение химических препаратов (базудин). Внесение мочевины под каждую культуру севооборота. Посев сидеральных культур после картофеля (озимая рожь).
Невидимый враг гровера — нематоды
При выращивании растений в гидропонных установках гровер сталкивается с множеством разнообразных проблем растений.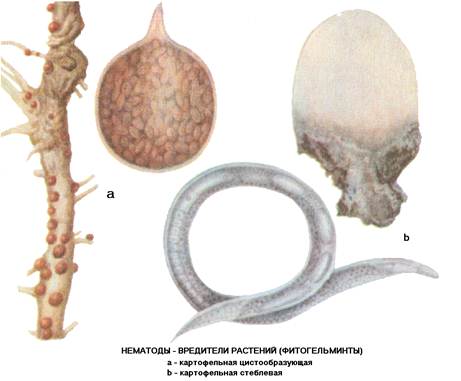
Некоторые виды насекомых-вредителей видны невооруженным глазом, их нетрудно заметить и можно уничтожить либо физически, либо используя инсектициды и прочие химические средства. Но есть и другие вредители, настолько маленькие, что их не видно. Основная опасность таких невидимых вредителей в гроувинге — именно их незаметность.
Как правило, признаки их присутствия проявляются, когда они уже в значительной степени размножились. Иногда растение уже не спасти. К таким бедам гидропонного выращивания относятся, в частности, нематоды.
Нематоды в гроувинге
Главная беда поражения этими вредителями, как уже было сказано выше, в том, что их можно обнаружить только путем лабораторного анализа. Представляют из себя нематоды червей, бесцветных и менее миллиметра в длину.
Особенностью нематод можно считать то, что они передвигаются очень быстро, живут на всем растении — цветах, листьях, стеблях, корнях. Кроме того, в гидропонном субстрате личинки нематод могут жить несколько месяцев, не теряя жизнеспособности.
Кроме того, в гидропонном субстрате личинки нематод могут жить несколько месяцев, не теряя жизнеспособности.
Признаки поражения нематодами растений на гидропонике
Если нематоды поселились в гидропонной установке, то сначала их можно и не заметить. Более того, самих нематод гровер, скорее всего, не увидит и вовсе никогда. Поэтому ориентироваться придется на внешние признаки.
Разные нематоды поражают разные участки растения. Например, стебли и корни поражает стеблевая нематода. Признаки поражения — вздутие на этих участках, своеобразные опухоли, часто — буроватые или с заметно потемневшими тканями. Листовая нематода поражает, соответственно, листья. При этом они начинают скручиваться, желтеть, сохнуть по краю. При сильном поражении растение имеет угнетенный вид целиком.
Большая проблема состоит в том, что нематоды очень быстро распространяются, причем как с растения на растение, так и по субстрату и даже по питательному раствору.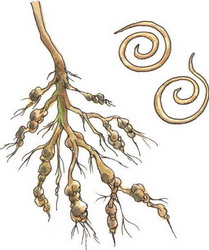 По этой причине избавиться от них непросто, даже в том случае, если пораженные растения из гидропонной установки удалили. Скорее всего, паразит уже поселился в гидропонном субстрате, на других растениях.
По этой причине избавиться от них непросто, даже в том случае, если пораженные растения из гидропонной установки удалили. Скорее всего, паразит уже поселился в гидропонном субстрате, на других растениях.
Как избавиться от нематод в гидропонике?
Борьба с этим паразитом — процесс достаточно сложный ввиду редкой жизнестойкости их личинок и быстрому распространению взрослых особей. Использование в гидропонных установках инсектицидов — метод в данном случае не только нежелательный, как и применение любых химикатов, но и неэффективный, так как при уничтожении взрослых нематод личинки, как правило, либо вовсе не страдают, либо страдает только очень малый их процент. Соответственно, через короткое время нематоды вновь начнут наступление на растения.
Поэтому, как ни жалко растений, при поражении нематодами придется их удалить из установки, а также заменить субстрат и тщательно обработать все компоненты установки, включая емкости, фильтры, трубы, шланги и так далее.
Если использовался волокнистый субстрат — кокосовое волокно, минеральная вата, то придется его выкинуть. Если же применялся керамзит, то есть возможность его спасти методом прокаливания в духовом шкафу. Прокалить субстрат нужно сильно, температура — около 200 градусов.
Что касается обработки гидропонной системы, то щадящее методы наподобие марганцовки здесь бессильны — личинки нематод просто не отреагируют на такую дезинфекцию. Поэтому придется использовать тот же метод, что и с субстратом, то есть высокую температуру. Понятно, что в духовке узлы системы не прокалить, зато можно обработать их горячим паром. Для этого можно использовать специальное устройство наподобие тех, что используются в химчистках для отпаривания одежды. Перед обработкой горячим паром систему нужно промыть. После обработки — протереть сухой тканью.
К сожалению, все растения, которые заразились нематодой, придется уничтожить.
Нематициды | Syngenta
Нематициды — химические вещества для уничтожения вредных растительноядных нематод. У пораженных нематодами растений наблюдается гибель корней, порча корнеплодов и образование галлов. Стеблевые нематоды вызывают растрескивание стеблей, гофрировку листьев и так далее. Особенно большой вред нематоды наносят в защищенном грунте и посадках картофеля.
У пораженных нематодами растений наблюдается гибель корней, порча корнеплодов и образование галлов. Стеблевые нематоды вызывают растрескивание стеблей, гофрировку листьев и так далее. Особенно большой вред нематоды наносят в защищенном грунте и посадках картофеля.
Нематициды различаются по механизму действия. Некоторые препараты обладают фумигантными свойствами — вызывают гибель нематод при проникновении в организм в парообразном или газообразном состоянии. Контактные нематициды уничтожают нематод при непосредственном контакте с кожным покровом. Нематициды системного действия поглощаются корнями или листьями растения и уничтожают нематод при питании клеточным соком. Способы, сроки и нормы применения нематицидов зависят от свойств и формы препарата, типа почв и условий среды, видов нематод и защищаемого растения.
Галловые нематоды относятся к многочисленной группе круглых червей. Болезни, вызываемые галловыми нематодами, называются мелоидогинозом — в грунтовых теплицах это одно из самых трудноискоренимых заболеваний. Наиболее широко распространена Южная галловая нематода. Галловые нематоды являются специализированными вредителями корневой системы, в защищенном грунте повреждают овощные культуры, особенно огурец, томат и салат, а также многие виды декоративных культур.
Наиболее широко распространена Южная галловая нематода. Галловые нематоды являются специализированными вредителями корневой системы, в защищенном грунте повреждают овощные культуры, особенно огурец, томат и салат, а также многие виды декоративных культур.
Золотистая (цистообразующая) картофельная нематода является объектом внешнего и внутреннего карантина Казахстана. Вызывает заболевание — глободероз картофеля и отличается высокой вредоносностью. Потери урожая картофеля колеблются от 25 до 90% в зависимости от степени заражения почвы и устойчивости сорта.
Проволочники — личинки жуков-щелкунов, семейство Щелкуны (Elateridae). Повреждаемые культуры: картофель, свекла, морковь, огурец, капуста, салат, редис, редька, дайкон, лук, а также полевые культуры. Опасный вредитель картофеля, вредоносность проявляется в период созревания клубней нового урожая. Поврежденные клубни теряют товарный вид и быстрее загнивают в хранилище. В местах повреждения быстро появляются заболевания клубней.:max_bytes(150000):strip_icc()/GettyImages-157591821-5c2d034d46e0fb0001ef8de8.jpg)
Нематоды разнокожие | справочник Пестициды.ru
Гетеродериды обладают высоким уровнем адаптации к корневому паразитизму, обеспечивающему гарантированные условия питания и защиты потомства от хищников и патогенных микроорганизмов в пределах цисты. Виды семейства способны сохранять жизнеспособность от года до десяти лет при отсутствии кормового растения.[3]
История
Цистообразующие нематоды впервые были найдены ботаником Шахтом на Магдебургской равнине на корнях сахарной свеклы. Позднее Шмидт назвал эту нематоду Heterodera schachtiiв честь ученого, нашедшего ее.
В последующие десятилетия цистообразующие нематоды были зарегистрированы на многих других сельскохозяйственных растениях: овсе, ячмене, горохе, клевере, картофеле и прочих. Долгое время все находки относили к одному виду – Heterodera schachtii.
В дальнейшем были выделены различные расы свекловичной нематоды, а затем и отдельные виды.[2]
Морфология
Имаго
Половозрелые особивсех представителей семейства Heterodera отличаются ярко выраженным половым диморфизмом. [2]
[2]
Половой диморфизм
Самки в течение развития принимают шаровидную, лимоновидную или грушевидную форму. Они способны образовывать многочисленные яйца, преимущественно остающиеся в теле и защищенные оболочкой (цистой).[2] Взрослые самкибелого цвета, неподвижные. Чаще всего на поверхности корня выступает часть или все тело самки. Передний конец тела всегда погружен в корень в месте питания.[3]
Циста. Размер колеблется от 0,2 до 1, 1 мм. Окрас в зависимости от вида и возраста светло-, темно- или красно-коричневый. Оболочка состоит из трех слоев.[2]
Самец.Тело стройное, длиной 1–1,5 мм. Хвост тупой, закругленный. Спикулы расположены вблизи кончика хвоста. Бурса отсутствует. У некоторых видов самцов нет и размножение происходит партеногенетическим путем.[2]
Яйцо
Форма продолговато-овальное. Размер варьирует от 89 х 42 мкм у хмелевой нематоды до 122 х 48 мкм у злаковой нематоды. Яйца в начале развития заполнены зернистым содержимым, позднее оно дифференцируется постепенным дроблением до образования личинки.[2]
Яйца в начале развития заполнены зернистым содержимым, позднее оно дифференцируется постепенным дроблением до образования личинки.[2]
Личинки инвазионные второго возраста
Длина – 0,4–0, 6 мм. Тело червеобразное. Обладают сильным ротовым стилетом и заостренным хвостом. Самые крупные – у овсяной и злаковой нематоды, самые мелкие – у капустной и хмелевой нематоды.[2]
Развитие
Имаго. Развитие самцов и самок нематод в половозрелом возрасте различное.[3]
Самка в начале развития имеет белую окраску. После откладки яиц самки отмирают и превращаются в цисту – выводковую камеру. Стенки цисты становятся прочными и темными. У некоторых видов проявляется коричневая окраска. Цисты покрыты субкристаллиновым слоем, состоящим из остатков личиночных оболочек. Позднее этот слой разрушается. Поэтому у некоторых видов они остаются белыми до момента его опадения.[2]
Самец живет не дольше 10 дней. Не питается. После оплодотворения отмирает.[3]
Не питается. После оплодотворения отмирает.[3]
Период спаривания. Самцы оплодотворяют самок сразу после наступления половой зрелости последних, поскольку самки выделяют привлекающее вещество. У некоторых видов самцов нет и размножение проходит партеногенетическим путем. В течение месяца после оплодотворения самки откладывают яйца. Их количество колеблется от нескольких штук до нескольких сотен. Некоторые виды образуют желатиновый мешок, расположенный на вульварном конце цисты. В него также откладывается часть яиц.[2]
Яйцо. Длительность эмбрионального развития зависит от условий окружающей среды и вида нематоды.[2]
Личинка. Развитие личинок протекает в несколько стадий.
Первая стадия протекает внутри яйцевой оболочки и завершает эмбриональное развитие. Поэтому цисты уже на ранних стадиях развития содержат многочисленные личинки первой стадии.
Вторая стадия. Личинки способны к передвижению и нападению на растения. Они выходят из цисты и свободно передвигаются в почве.
Личинки проникают в растение в основном сразу позади кончика корня. После этого их тело слегка утолщается. Вторая стадия завершается линькой через 1–2 недели после проникновения в растение.
Третья стадия. Личинка утолщается до бутылковидной формы. Половые органы заметны. Ректум виден ясно.
Четвертая стадия. Личинка, развивающаяся в самку, утолщается. Из-за этого корень разрывается и задний конец самки выступает наружу. Самки развиваются дольше самцов.
Будущие самцы приобретают червеобразную форму, перестают питаться. Развивающиеся самцы лежат в личиночной шкурке, сложенные многократно. Длится стадия 4–5 дней. Самцы выползают из шкурок и покидают корни.[2]
Имаго. Самцы оплодотворяют самок и отмирают. Самки откладывают яйца в полость своего тела и превращаются в цисты. [3]
[3]
Особенности развития. Длительность развития одного поколения и количество генераций зависит от вида нематоды, растения-хозяина и условий окружающей среды.[3]
Географическое распространение
Семейство гетеродерид имеет широкое распространение. Представители этого семейства встречаются практически по всему миру.[2]
Меры борьбы
Агротехнические методы
В открытом грунте
- Введение в севооборот культур, не поражаемых нематодами.
- Борьба с сорняками – хозяевами нематод семейства гетеродерид.[2]
Механические методы
Применяются в теплицах.
- Обеззараживание почвы путем выпаривания или вымораживания.
- Предотвращение занесения нематод в незараженный грунт.
- Полив чистой водопроводной водой.
- Уничтожение пораженных частей растений.[2]
Химические методы
Протравливание почвы нематицидами. [1]
[1]
Борьба с нематодой в полях и теплицах
Борьба с вредителями растений, которые обитают в грунте, представляет особые трудности. Причиной, этого является большой объем почвы, который заселяют паразит.
Нематода может передаваться через почву, навоз, на корнях растений, так как обычно находится в верхнем почвенном слое на глубине 20—22,5 см. Для того чтобы средство для уничтожения вредителя оказалось эффективным, оно должно повсеместно проникнуть в весь объем почвы, заселяемый нематодой, иначе может произойти повторное заражение. Меры борьбы определяются в зависимости от того, какой нематодой был заражён участок.
Агротехнические методы борьбы с нематодой
Средства борьбы с нематодой без использования химикатов это — соблюдение севооборота и ухода за растениями.
Для повышения плодородия и частичного уничтожения нематоды освободившийся после уборки участок в августе – начале сентября хорошо засеять зерновыми (лучше озимыми) культурами. Выбор сортов и гибридов, относительно устойчивых к нематодному поражению. Тщательный отбор здорового посевного материала. Также, высадка в междурядьях фитонцидных растений, например, бархатцев или календулы, поможет отпугнуть вредителей.
Выбор сортов и гибридов, относительно устойчивых к нематодному поражению. Тщательный отбор здорового посевного материала. Также, высадка в междурядьях фитонцидных растений, например, бархатцев или календулы, поможет отпугнуть вредителей.
Одним из самых надежных методов борьбы с нематодой является термическая обработка корней. Пораженное растение вынимается из земли, корни отмываются, после чего все растение промывается в воде при температуре 50-55°С.
При температуре свыше 40°С взрослые нематоды и большинство яиц гибнут. Максимально устойчивыми к изменению условий жизни являются яйца нематод.
Отрицательно влияют на нематод также ультрафиолетовые лучи, поэтому чаще всего заражению подвержены те участки, где недостаточно солнечного света.
Химические средства борьбы с нематодами
Эффективно бороться с этим вредителем в саду, на огороде, на полях сегодня можно лишь с помощью нематоцидов – группы химических веществ, уничтожающих растительноядных нематод.
Одни из них могут использоваться в качестве фумигантов – ядовитых газов, отравляющих вредителей при проникновении в их дыхательную систему. Другие – как контактный яд, который отравляет червей, впитываясь прямо через их покровы или системного действия, которые делают растение ядовитым для нематод.
Нематоциды-фумиганты используют путем внесения их в почву, а также для предпосевной обработки семян, луковиц, клубней или корней рассады в борьбе с червями, паразитирующими на корнях растений. Фосфорорганические нематоциды — способом опрыскивания растений для уничтожения листовых и стеблевых нематод.
Некоторые нематоциды обладают комплексным действием, являясь одновременно фунгицидными, инсектицидными и гербицидными средствами. Они приводят к полной стерилизации почвы (посев на ней возможен лишь через 20-50 дней после обработки, а для особо токсичных – и вовсе только в следующем посевном сезоне).
Узнать цену
Профилактика от нематод. Обеззараживание теплиц
Профилактика — основное мероприятие, которое помогает защитить теплицы от заражения нематодами.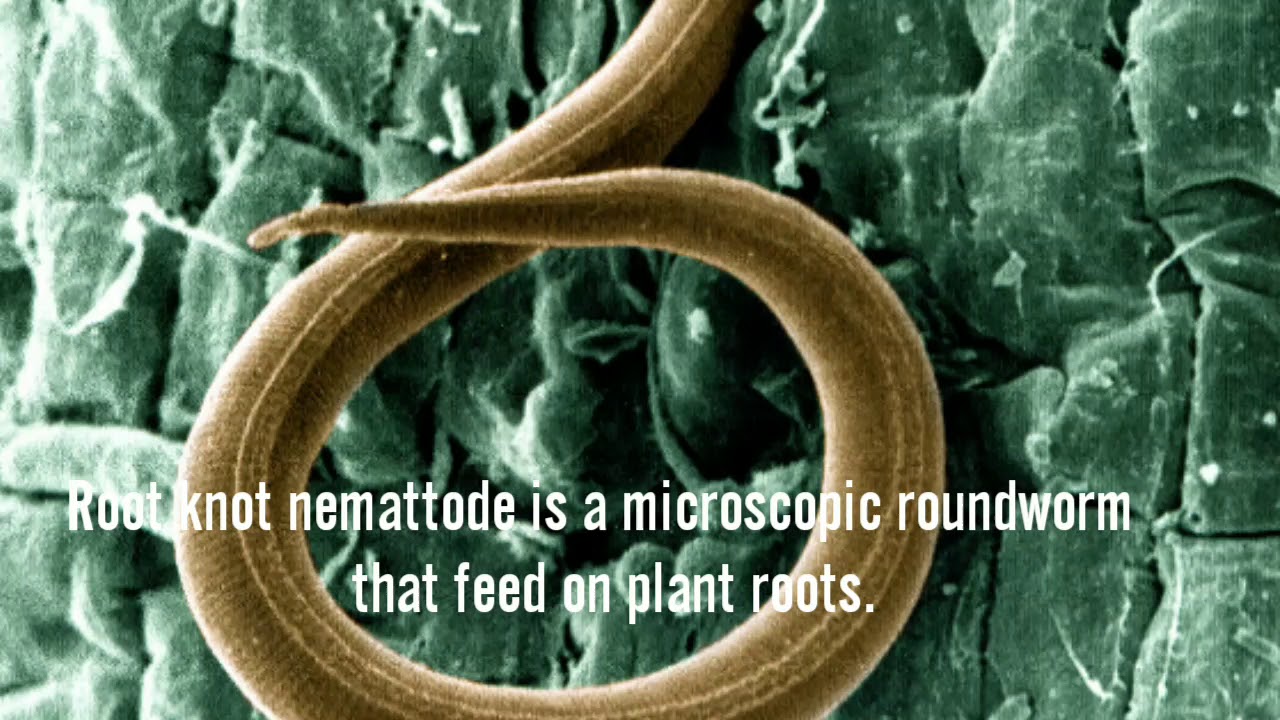 Она позволяет значительно сократить количество нематод в почве и сохранить значительную часть урожая.
Она позволяет значительно сократить количество нематод в почве и сохранить значительную часть урожая.
Наиболее эффективно использование севооборотов с возвращением культуры на прежнее место через 3-5 лет, но в тепличном производстве это практически не возможно, также необходимо уничтожать сорную растительность, которая является пищей для нематод.
Хорошо себя проявляет также обработка посадочного материала химическими препаратами (протравливание), или термическая обработка растений перед посадкой. Также надо обязательно дезинфицировать все, что имеет отношение к растениям, — это помещения, инструменты, оборудование, ящики, корзины для грибов и т.д.
Дезинфекцию теплиц выполняют после тщательной очистки и мойки поверхностей методом влажного распыления рабочего раствора с помощью ручных распыляющих устройств. Обработку осуществляют, предварительно закрыв двери, окна, вентиляционные люки обрабатываемого помещения.
Необходима тщательная мойка машин после окончания операций, а также дезинфекция машин, механизмов и ручного инвентаря перед началом работы.
Растения с признаками поражения нематодами следует, незамедлительно уничтожать. Наиболее эффективно сжигать зараженные растения или глубоко закопать за пределами участка, почву под зараженным растением следует убрать либо обработать ее формалином или хлорной известью.
Узнайте ответы на все интересующие вас вопросы или закажите услугу по телефону 8-800-600-19-33.
Селекционеры наносят ответный удар | Научные открытия и технические новинки из Германии | DW
770 миллионов евро — в такую сумму оценивается ущерб, причиняемый из года в год посевам сои так называемой соевой цистообразующей нематодой (Нeterodera glycines). И это в одних только США, а в мировом масштабе счет давно идет на миллиарды. Соевая цистообразующая нематода — один из видов паразитических круглых червей, вредитель сои, повреждающий, в первую очередь, корни растения. Хотя соевую нематоду и разглядеть-то трудно, ведь ее длина не превышает 1,5 миллиметра, пораженные паразитом растения имеют угнетенный вид, им свойственна низкорослость, у них пожелтевшие листья, а главное — они дают низкий урожай бобов.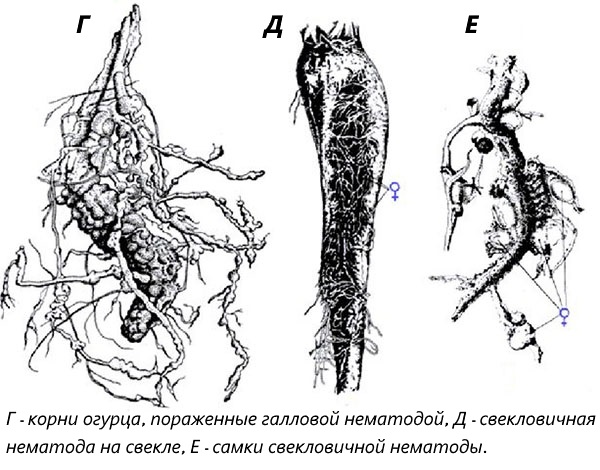 Кроме того, такие растения гораздо более чувствительны к другим паразитам и патогенам и самым разным формам стресса.
Кроме того, такие растения гораздо более чувствительны к другим паразитам и патогенам и самым разным формам стресса.
Нематода преодолевает резистентность сои
Способов борьбы с этим вредителем как таковым практически нет, так что единственный путь защиты урожая — это культивирование сортов сои, от природы резистентных к нематоде. Беда лишь в том, что нематоды со временем обретают способность обходить защитный механизм растений — подобно тому, как бактерии вырабатывают невосприимчивость к тому или иному антибиотику. Поэтому те очень немногие сорта сои, на которые селекционеры делали ставку на протяжении последних десятилетий, сегодня все чаще оказываются неспособными противостоять нематоде.
И исследователи многих стран не жалеют сил и средств на изучение механизмов, регулирующих резистентность сои к нематоде, в надежде найти новые пути в борьбе с паразитом. Это задача не из легких, тем более что устойчивость растения к вредителям носит в целом более сложный и многообразный характер, нежели, скажем, устойчивость того же самого растения к болезням.
Резистентность резистентности рознь
Теперь группе американских исследователей, изучавших генетику сои, судя по всему, удалось добиться значительного успеха. Мелисса Митчум (Melissa Mitchum), фитопатолог Миссурийского университета в городе Колумбия, поясняет: «Большинство известных нам генов резистентности растений кодируют белки, расположенные на клеточных мембранах. Эти белки являются рецепторами, они реагируют на инвазию нематоды и тотчас запускают иммунный ответ растения».
Таков, так сказать, стандартный механизм. Именно этот механизм обеспечивает резистентность давно известных и широко культивируемых сортов сои. Однако наиболее устойчивые к нематоде растения, очевидно, имеют в своем арсенале и другие, более эффективные средства защиты от паразита. Мелисса Митчум поясняет: «В нашем случае, ген, который мы теперь обнаружили, регулирует метаболизм растения. То есть он кодирует белок, который расположен не на мембране клетки, а внутри нее. Очевидно, тут имеет место совершенно иной механизм резистентности, отличный от известных нам прежде».
Фолиевая кислота как оружие против паразита?
Правда, детали этого механизма остаются пока загадкой. Исследователи могут лишь строить предположения о том, как новый ген регулирует иммунный ответ. Ясно лишь, что этот ген необходим для синтеза фолиевой кислоты, а фолиевая кислота — чрезвычайно важный витамин, участвующий, например, в репликации ДНК и, значит, играющий ключевую роль в делении клеток. Таким образом, потребность в фолиевой кислоте особенно велика в периоды наиболее быстрого развития и роста организма. Но животные, включая человека, не способны синтезировать этот витамин, а потому должны получать его с пищей. Зато фолиевая кислота в больших количествах содержится во многих растениях, в том числе и в бобовых. Поэтому одна из гипотез касательно нового механизма резистентности сои к нематоде сводится к тому, что растение блокирует синтез фолиевой кислоты в тех корнях, куда проник паразит, и тот, лишенный важного витамина, погибает.
В селекции сои ожидается бум
Впрочем, все это пока не более чем догадки. Исследования в этом направлении будут продолжены, но определенные практические выводы можно делать уже сегодня, подчеркивает Мелисса Митчум: «На протяжении полувека по всему миру выращивались одни и те же резистентные к нематоде сорта сои. Это уже почти монокультура, поэтому не приходится удивляться, что сегодня во многих регионах есть нематоды, способные преодолевать эту резистентность и инфицировать посевы сои. Мы же, фитопатологи, годами блуждали в темноте, пытаясь понять, как функционирует иммунный ответ растения на инвазию этого паразита, и обнаружить гены, регулирующие этот ответ».
По крайней мере, один такой многообещающий ген теперь найден. Результаты, полученные учеными Миссурийского университета, чрезвычайно обрадовали их коллегу, профессора фитопатологии университета Джорджии в Атенсе Ричарда Хасси (Richard Hussey): «Ничего более замечательного для меня просто быть не может! Это открытие породит настоящий бум в практической селекции, потому что теперь стало понятно, о каком гене идет речь. Благодаря новой информации селекционеры смогут разработать молекулярные маркеры, которые позволят быстро выявлять наличие или отсутствие этого самого гена резистентности в том или ином сорте сои. Понятно, что это резко повысит скорость и точность селекционной работы».
границ | Иммунные реакции растений на паразитических нематод
Введение
Паразитические растения-нематоды (PPN) являются одними из самых разрушительных сельскохозяйственных вредителей во всем мире с ежегодными глобальными потерями урожая примерно в 80 миллиардов долларов США (Jones et al., 2013). PPN поражают широкий спектр коммерчески важных семейств сельскохозяйственных культур, таких как Solanaceae (томат, картофель, перец), Fabaceae (соя), Malvaceae (хлопок), Amaranthaceae (сахарная свекла) и Poaceae (син. Gramineae; рис, пшеница и т. Д.). кукуруза).В целом, экономически важные PPN имеют широкий спектр хозяев и очень вирулентны. PPN могут обладать сложной вирулентной стратегией, поскольку они могут инфицировать многие растения, не вызывая сильных иммунных ответов (Warmerdam et al., 2018). Эта характерная особенность затрудняет выделение мутантов Arabidopsis thaliana с дефектом иммунитета против PPN. Однако недавний прогресс в геномике растений и нематод открыл путь к пониманию механизмов распознавания PPN-инфекцией растений.В настоящее время ведется большая работа, связанная с иммунными, толерантными и восприимчивыми ответами видов растений на инфекцию нематодами (обобщенные в дополнительной таблице 1). В этом обзоре мы суммируем известные механизмы распознавания растений для инфекции PPN и иммунные ответы хозяина на PPN. Кроме того, мы обсуждаем, как разные системы распознавания активируют разные иммунные ответы.
Жизненные циклы PPN
PPN делятся на три основные группы в зависимости от пищевого поведения: эктопаразитарные, полуэндопаразитарные и эндопаразитарные (Decraemer and Hunt, 2013; Palomares-Rius et al., 2017; Smant et al., 2018). Эктопаразитические нематоды проводят весь свой жизненный цикл вне организма-хозяина, при этом единственным физическим контактом является введение длинного и жесткого стилета для кормления (рис. 1А). Полуэндопаразитические нематоды проникают в корни для питания, а задняя часть остается в почве. Эндопаразитарные нематоды полностью проникают в корень и питаются внутренними тканями. Каждый из этих типов питания делится на мигрирующий или малоподвижный образ жизни. Например, мигрирующие эндопаразиты (e.g., пораженные корнем нематоды Pratylenchus spp. и роющие нематоды Radopholus spp.) мигрируют через ткани корня, чтобы питаться растительными клетками, вызывая повреждение тканей по мере их миграции (Рисунок 1B), тогда как малоподвижные эндопаразиты перемещаются в сосудистый цилиндр и вызывают повторную дифференцировку клеток-хозяев в многоядерные и гипертрофические питающие клетки. Двумя основными PPN в малоподвижной группе являются корневые нематоды (RKN) из рода Meloidogyne и цистовые нематоды (CNs), включая роды Globodera и Heterodera (рисунки 1C, D).RKN и CN являются самыми разрушительными нематодами в мире (Jones et al., 2013).
Рисунок 1 Стратегии заражения PPN (A) Эктопаразиты поглощают питательные вещества из растительных клеток, не вторгаясь в корень растения. Некоторые эктопаразиты, такие как игольчатые нематоды ( Longidorus spp.) И кинжальные нематоды ( Xiphinema spp.), Вызывают образование питательных клеток, что продлевает период кормления. (B) Мигрирующие эндопаразиты проникают внутрь тканей корня, вызывая разрушение на пути и питаясь тканями растений.Сидячие эндопаразиты включают нематоды корневых узлов (RKNs), Meloidogyne spp. и цистовые нематоды (CN), включая Globodera spp. и Heterodera spp. (C) Молодь RKN второй стадии попадает в корень около кончика корня, затем мигрирует межклеточно в сосудистый цилиндр, где они репрограммируют ткани корня в гигантские клетки. После образования гигантских клеток молодь RKN становится малоподвижной и поглощает питательные вещества и воду через стилет для кормления.Взрослые самки RKN образуют яичную массу на поверхности корня или под ним. (D) Молодые особи ХН на второй стадии перемещаются внутри корня внутриклеточно, вызывая разрушение тканей растения по мере продвижения и устанавливая синцитии в тканях сосудов в качестве питающих клеток. Молодь CN также становится малоподвижной и начинает питаться синцитией. Взрослые самки CN сохраняют яйца внутри тела, которые после смерти образуют кисту.
И RKN, и CN индуцируют повторную дифференцировку клеток-хозяев для создания питающих клеток для собственного развития и размножения, но двумя разными способами.Инфицированная молодь RKN проникает около кончика корня и межклеточно мигрирует в сосудистый цилиндр, где образуются питающие клетки. Как только RKNs попадают в благоприятное место, они вызывают повторную дифференцировку растительных клеток в многоядерные гигантские клетки путем повторных ядерных делений без цитоплазматического деления (Abad et al., 2009; Escobar et al., 2015). Примерно через 4–6 недель после заражения зрелая взрослая самка RKN грушевидной формы откладывает яйца в студенистой яичной массе на поверхности корня или под ней (Abad et al., 2009; Эскобар и др., 2015). РКН демонстрируют различные режимы воспроизводства, такие как амфимиксис, факультативный партеногенез и облигатный партеногенез. В частности, наиболее разрушительные виды RKN, Meloidogyne incognita , Meloidogyne arenaria и Meloidogyne javanica , размножаются путем облигатного партеногенеза, а самцы, по-видимому, не играют никакой роли в воспроизводстве (Castagnone-Sereno, 2006). Молодь CN проникает в корень и перемещается внутриклеточно в сосудистый цилиндр, где, в отличие от RKN, они индуцируют синцитии за счет местного растворения клеточных стенок и слияния протопластов с соседними растительными клетками.Сотни яиц производятся внутри тела самки после спаривания. Когда самка умирает, ее тело образует цисту, которая может защищать яйца в течение многих лет в почве (Bohlmann, Sobczak, 2014; Bohlmann, 2015). И RKN, и CN секретируют эффекторы вирулентности через стилет, чтобы манипулировать клетками-хозяевами для создания питающих клеток. PPN секретируют эффекторы, включая ферменты, разрушающие клеточную стенку, ингибиторы анти-нематодных ферментов растений, супрессоры иммунной сигнализации растений и белки, необходимые для создания питающих клеток (Davis et al., 2008; Гейзен и Митчум, 2011; Хевези и Баум, 2013; Говерс и Смант, 2014; Smant et al., 2018; Mejias et al., 2019).
Распознавание PPN
В целом патогены у растений воспринимаются несколькими различными системами распознавания (Jones and Dangl, 2006; Dodds and Rathjen, 2010). Первая система распознавания опосредуется восприятием ассоциированных с патогенами молекулярных паттернов (PAMP) (например, бактериального флагеллина, грибного хитина) и ассоциированных с повреждениями молекулярных паттернов (DAMP), выделяемых поврежденными тканями растения-хозяина.PAMPs и DAMPs воспринимаются рецепторами распознавания образов (PRR), локализованными на клеточной поверхности, что приводит к иммунитету, запускаемому образцом (PTI) (Boutrot and Zipfel, 2017; Hou et al., 2019). PRR растений обычно представляют собой рецептор-подобные киназы (RLK) или рецептор-подобные белки (Boutrot and Zipfel, 2017). Успешные патогены секретируют эффекторные белки в апопласт и цитоплазму хозяина, чтобы препятствовать распознаванию и передаче иммунных сигналов. Однако у устойчивых растений эти эффекторы часто распознаются иммунными сенсорами типа лейцин-богатых повторов (NLR) внутриклеточного нуклеотид-связывающего домена, что приводит к иммунитету, запускаемому NLR (Cui et al., 2015). N-конец белков NLR обычно содержит домен рецептора толл-интерлейкина 1 (TIR) или спиральную спираль (CC), которые используются для классификации белков NLR на две подгруппы TIR-NLR и CC-NLR. Кроме того, некоторые PRR у устойчивых растений также распознают эффекторы апопласта, чтобы индуцировать PTI.
Известно, чтоPPN индуцируют PTI у растений. Например, аскарозид, эволюционно законсервированный феромон нематод, является первым и единственным идентифицированным PAMP нематод (Manosalva et al., 2015).Ascr № 18, самый распространенный аскарозид в PPN, активирует типичные иммунные ответы растений, такие как митоген-активируемые протеинкиназы, экспрессия гена маркера PTI и пути передачи сигналов, опосредованные салициловой кислотой и жасмоновой кислотой (JA). Важно отметить, что обработка Ascr # 18 увеличивает устойчивость как к RKN, так и к CN у Arabidopsis . Более того, Ascr № 18 также распознается томатами, картофелем и ячменем, что позволяет предположить, что распознавание Ascr № 18 хорошо сохраняется как у однодольных, так и у двудольных.Однако соответствующий PRR для распознавания Ascr # 18 еще не идентифицирован. Первым идентифицированным PRR, участвующим в индукции PTI в ответ на молекулу, производную PPN, является богатый лейцином повтор (LRR) -RLK, кодируемый Arabidopsis Nilr1 ( индуцированный нематодами LRR-RLK 1 ) (Mendy et al. ., 2017). NILR1 был выделен в качестве важного компонента для распознавания «NemaWater», водного раствора, инкубированного с мальками CN ( Heterodera schachtii ) и RKN ( M.incognita ) в качестве индукторов PTI. Интересно, что внеклеточный рецепторный домен NILR1 широко консервативен среди двудольных и однодольных, что согласуется с тем фактом, что NemaWater активирует иммунные ответы у томатов, сахарной свеклы, табака и риса. Однако соответствующая молекула PAMP, распознаваемая NILR1, не была идентифицирована. Важность PTI для иммунитета против PPN также была продемонстрирована на мутантах Arabidopsis с дефицитом PTI (Teixeira et al., 2016; Mendy et al., 2017). Восприимчивость Arabidopsis к RKNs была увеличена у мутантов bak1–5 и bik1 (Teixeira et al., 2016). BAK1 является корецептором для многих PRR, индуцирующих PTI, а в мутанте BIK1 он является необходимой рецептор-подобной цитоплазматической киназой для передачи сигналов PTI. bak1–5 и bak1–5 bkk1 (BKK1 — ближайший гомолог BAK1) мутанты более чувствительны к ХН (Mendy et al., 2017). Важно отметить, что RKN и CN обладают множественными эффекторами вирулентности, которые способны подавлять ответы PTI (Chen et al., 2013; Jaouannet et al., 2013; Lin et al., 2016; Чен и др., 2018; Naalden et al., 2018; Куд и др., 2019; Ян и др., 2019). Инфекции PPN вызывают повреждение клеток-хозяев, таким образом, они, вероятно, продуцируют DAMP (ы), что приводит к индукции PTI. Например, ХН мигрируют внутриклеточно, таким образом, их миграция приводит к высвобождению олигогалактуронидов (ОГ) из стенок растительных клеток. Грибковые патогены продуцируют ферменты, разрушающие клеточную стенку, такие как полигалактуроназа (PG), для переваривания материалов клеточной стенки растений (D’Ovidio et al., 2004), и большинство растений имеют белки-ингибиторы полигалактуроназы (PGIP), которые ослабляют деградацию пектина PG, что приводит к высвобождению OG. Высвобожденные длинноцепочечные OG активируют PTI (Bishop et al., 1981; Hahn et al., 1981; Nothnagel et al., 1983; Benedetti et al., 2015). Arabidopsis имеет два PGIP, PGIP1 и PGIP2, оба из которых быстро экспрессируются во время стадии миграции CN. Генетическое исследование показало, что PGIP1 активирует камалексиновый и индол-глюкозинолатный пути растений, тем самым ослабляя инфекцию CN (Shah et al., 2017). Кроме того, экзогенная обработка OG повышает устойчивость к CN. Эти результаты предполагают, что при заражении CN Arabidopsis PGIP1 высвобождает OG, запуская PTI (Shah et al., 2017). Кроме того, инфекция CN вызывает выработку этилена хозяином, этап передачи сигнала, который задерживает установление синцитиальной фазы, указывая на то, что индуцированные повреждением ответы этилена вносят вклад в иммунитет против CN (Marhavý et al., 2019). Напротив, пока нет четких доказательств индуцированного повреждением иммунитета против RKN, которые мигрируют межклеточно и, таким образом, менее деструктивны, чем CN.Напр., Ни PGIP1, ни PGIP2 не индуцируются во время стадий миграции RKN, и PGIP-опосредованные ответы DAMP не требуются для устойчивости против RKN (Shah et al., 2017). Сходным образом потеря других рецепторов DAMP, PEPR1 и PEPR2 для растительных элиситорных пептидов или DORN1 для внеклеточного АТФ, не влияет на восприимчивость к RKN (Teixeira et al., 2016). Однако возможно, что неизвестные DAMP могут быть важны для индукции иммунитета против RKN, поскольку активация PTI экзогенным применением известных DAMP довольно эффективна для подавления репродукции RKN (Lee et al., 2018).
Белки NLR также играют критическую роль в распознавании PPN. NLR, участвующие в распознавании PPN, в основном кодируются генами устойчивости ( R ) (Kaloshian et al., 2011). Хорошо изученные гены R включают томат Mi-1.2 , Mi-9 и Hero-A ; картофель ГПа2 и Гро1–4 ; перец CaMi ; и чернослив млн лет назад (Миллиган и др., 1998; ван дер Фоссен и др., 2000; Эрнст и др., 2002; Паал и др., 2004; Чен и др., 2007; Яблонска и др., 2007; Claverie et al., 2011). Mi-1.2 , Mi-9 , CaMi и Ma обеспечивают сопротивление против RKN, а Hero-A , Gpa2 и Gro1–4 обеспечивают сопротивление CN. Gro1–4 и Ma кодируют TIR-NLR, тогда как остальные кодируют CC-NLR. Интересно, что белок Ма имеет большую и высокополиморфную С-концевую пост-LRR-область, которая, как считается, важна для распознавания PPN (Claverie et al., 2011). Известно несколько примеров факторов авирулентности PPN, распознаваемых NLR. Gp-RBP-1, один из белков секретируемого домена SP1a и рецептора рианодина (SPRYSEC) из CN Globodera pallida , является эффектором, который вызывает гиперчувствительный ответ (HR) — гибель клеток в присутствии GPA2 и Ran GTPase. -активирующий белок 2 (RanGAP2) (Blanchard et al., 2005; Sacco et al., 2009). Остаток пролина в положении 187 в домене SPRY Gp-RBP-1 необходим для распознавания GPA2, тогда как аллель варианта вирулентного типа Gp-RBP-1 имеет мутацию в этом положении, что позволяет ему избежать распознавания хозяином.Более того, RanGAP2 взаимодействует с CC доменом GPA2 (Tameling and Baulcombe, 2007), указывая тем самым, что комплекс RanGAP2-GPA2 необходим для распознавания SPRY домена Gp-RBP-1. Другим примером фактора авирулентности, распознаваемого растениями, является Cg-1 в M. javanica , RKN. Ген Cg-1 присутствует в вирулентной популяции Mi — 1.2 , но вирулентные штаммы RKN несут делецию Cg-1 (Gleason et al., 2008; Gross and Williamson, 2011).Более того, подавление Cg-1 в авирулентном штамме увеличивало вирулентность томата, содержащего Mi-1.2 , что предполагает возможную роль Cg-1 как фактора, распознаваемого R-белком Mi-1.2, хотя его механизм передачи сигнала является не понятно.
Известно также, что PRR, локализованные на поверхности, распознают эффекторы PPN. Ядовитый аллергеноподобный белок Gr-VAP1 из CN Globodera rostochiensis взаимодействует с апопластной папаин-подобной цистеиновой протеазой (PLCP) RCR3 pim в томате для подавления иммунитета хозяина (Lozano-Torres et al., 2012). Однако Cf-2, локализованный на плазматической мембране рецептор-подобный белок с внеклеточными LRR, распознает взаимодействие Gr-VAP1 с RCR3 pim , вызывая гибель HR-клеток у резистентных хозяев. Примечательно, что Cf-2 первоначально был идентифицирован как ген устойчивости против грибкового патогена Cladosporium fulvum (Rooney et al., 2005). Подобно Gr-VAP1, C. fulvum секретирует AVR2, который взаимодействует и ингибирует RCR3 pim , и это взаимодействие распознается белком Cf-2.Таким образом, Cf-2 распознает патогены как грибков, так и нематод, отслеживая RCR3 pim .
Секреция анти-нематодных ферментов в апопласт
Тот факт, что эффектор Gr-VAP1 PPN ингибирует RCR3 pim , PLCP, означает, что его ферментативная активность важна для иммунитета против PPN (рис. 2A). Действительно, отсутствие гомологов RCR3 pim в Arabidopsis приводит к повышенной чувствительности к CN (Lozano-Torres et al., 2014). Помимо Gr-VAP1, Mc1194, эффектор RKN Meloidogyne chitwoodi нацелен на другой PLCP, RD21A в Arabidopsis (Davies et al., 2015b). Отсутствие RD21A приводит к гиперчувствительности к M. chitwoodi , показывая, что этот PLCP также играет положительную роль в иммунитете против RKN. Однако пока неизвестно, как эти PLCP подавляют инфекцию PPN.
Рисунок 2 Множественные иммунные ответы растений против PPN (A) Растения секретируют анти-нематодные ферменты, такие как папаин-подобные цистеиновые протеазы (PLCP) и хитиназы, в апопласт для атаки PPN. (B) Устойчивые растения продуцируют широкий спектр вторичных метаболитов в ответ на инфекцию PPN.Некоторые метаболиты подавляют вылупление яиц, подавляют подвижность мигрирующих PPN, останавливают рост и развитие или убивают нематод. Растения также могут уменьшить хемоаттрактант, выделяя меньше аттрактантов или больше репеллентов. (C) Растения укрепляют свои клеточные стенки за счет накопления лигнина, суберина и каллозы, которые усиливают физический барьер для PPN. (D) PPN-инфекция индуцирует продукцию ROS, которая может быть непосредственно токсичной для PPN. Перекись водорода играет роль в сшивании клеточной стенки.АФК могут также работать как передающий сигнал для активации иммунных ответов и контроля гибели HR-клеток. (E) Продукция NO индуцируется при инфицировании PPN и может играть роль в JA-опосредованных защитных ответах, возможно, за счет продукции ингибитора протеазы 2. (F) Гибель HR-клеток имеет решающее значение для ограничения движения PPN и завершения жизненный цикл. (F-1) Гибель HR-клеток происходит во время проникновения и миграции PPN в кортикальных и эпидермальных тканях, что способствует ингибированию миграции. (F-2) Смерть HR-клеток индуцируется в клетках, инфицированных RKN или CN, которые ингибируют образование питающихся клеток. (F-3) Смерть HR-клеток также индуцируется в клетках, окружающих питающие клетки, что часто приводит к дегенерации питающих клеток. Даже если некоторые питающие клетки выживают, транспорт питательных веществ от окружающих тканей к питающим клеткам ограничен, что приводит к сокращению количества яиц и производству относительно большего количества самцов. Некоторые устойчивые растения вызывают ухудшение питательных клеток без какой-либо гибели HR-клеток окружающих клеток.
Хитиназы также являются потенциально важными апопластными ферментами в иммунитете против PPN (рис. 2A). При грибковой инфекции растения часто секретируют хитиназы, которые разрушают хитин в клеточных стенках грибов (Kumar et al., 2018; Pusztahelyi, 2018). У нематод хитин является основным компонентом скорлупы яйца (Clarke et al., 1967; McClure, Bird, 1976; Perry and Trett, 1986) и составляет часть стенок просвета глотки Caenorhabditis elegans (Zhang et al. ., 2005), предполагая, что хитиназы могут обладать анти-нематодной активностью и, таким образом, способствовать иммунитету против PPN.В соответствии с этой идеей, активность хитиназы и уровни транскриптов повышаются после инфицирования PPN у устойчивых растений (Qiu et al., 1997; de-Deus Barbosa et al., 2009; Bagnaresi et al., 2013). Однако в настоящее время нет генетических доказательств, связывающих хитиназы растений с устойчивостью к PPN.
Производство соединений против нематод
Растения продуцируют вторичные метаболиты в ответ на инвазию PPN (рис. 2B). Например, хлорогеновая кислота, фенольное соединение, производится на различных заводах, включая пасленовые (Milne et al., 1965; Хунг и Роде, 1973; Pegard et al., 2005), морковь (Knypl et al., 1975) и рис (Plowright et al., 1996), предполагая общий защитный ответ против инфекции PPN. Хотя производство хлорогеновой кислоты хорошо коррелирует с уровнями устойчивости к PPN, сама по себе хлорогеновая кислота слабо нематицидна для M. incognita (Mahajan et al., 1985; D’Addabbo et al., 2013) с умеренной активностью против Nacobbus aberrans , нематода ложного корневого узла (López-Martínez et al., 2011). Одно из возможных объяснений отсутствия корреляции между ответом и эффективностью состоит в том, что продукты метаболизма хлорогеновой кислоты обладают более высокой нематицидной активностью в организме-мишени, но эти соединения могут быть нестабильными или высокотоксичными для растений. Хлорогеновая кислота может быть гидролизована до хинной кислоты и кофейной кислоты, причем последняя дополнительно окисляется до ортохинона, который токсичен для PPN (Mahajan et al., 1985). Однако роль кофеиновой кислоты и ортохинона в устойчивости к PPN требует дальнейшего изучения.
Другое фенольное соединение, фенилфеналенон анигоруфон, накапливается в местах инфицирования роющей нематоды Radopholus similis у устойчивого сорта банана ( Musa sp.) (Dhakshinamoorthy et al., 2014; Hölscher et al., 2014). Анигоруфон обладает высокой нематицидной активностью из-за образования крупных липид-анигоруфоновых комплексов в организме R. similis . Анигоруфон также известен как противогрибковый фитоалексин, и его синтез активируется при заражении патогенным грибком Fusarium oxysporum (Luis et al., 1995). Интересно, что анигоруфон также убивает простейшего паразита человека Leishmania за счет ингибирования сукцинатдегидрогеназы в митохондриальном респираторном комплексе II (Luque-Ortega et al., 2004). Однако токсический механизм действия анигоруфона в PPN и его связь с образованием больших липидно-анигоруфоновых комплексов еще предстоит определить.
Флавоноиды составляют большой класс вторичных метаболитов растений. Некоторые флавоноиды играют важную роль в устойчивости к PPN, действуя как нематоциды, немастатические соединения (которые не убивают, а подавляют их движение), репелленты или ингибиторы вылупления яиц (Chin et al., 2018). Эти флавоноиды, обладающие анти-нематодной активностью, в основном относятся к классам флавонолов (например, кемпферол, кверцетин, мирицетин), изофлавоноидов и птерокарпанов (например, медикарпин, глицеоллин). Кемпферол подавляет вылупление из яиц R. similis (Wuyts et al., 2006b). Кемпферол, кверцетин и мирицетин являются репеллентами и немастатическими для молодых особей M. incognita (Wuyts et al., 2006b), а медикарпин также ингибирует подвижность Pratylenchus Penetrans в зависимости от концентрации (Baldridge et al., 1998). Точно так же патулетин, патулитрин, кверцетин и рутин являются нематицидными для инфекционных молодых особей Heterodera zeae , CN (Faizi et al., 2011). Синтез некоторых флавоноидов также индуцируется при инфицировании устойчивых растений. Например, устойчивые к M. incognita сорта сои накапливают глицеоллины, группу специфичных для сои пренилированных фитоалексинов птерокарпана, которые экспрессируются при заражении (Kaplan et al., 1980). Интересно, что глицеоллин подавляет подвижность M.incognita (Каплан и др., 1979; Каплан и др., 1980). Накопление глицеоллина также выше у устойчивых к CN сортов сои, чем у восприимчивых. Один из изомеров глицеоллина, глицеоллин I, накапливается в тканях, прилегающих к головке CN в устойчивых корнях сои (Huang and Barker, 1991), что позволяет предположить, что накопление глицеоллина является пространственно-временным специфическим для участка инфекции.
Помимо фенольных соединений, некоторые нематодные химические вещества производятся несколькими растениями-антагонистами нематод, такими как бархатцы и спаржа, которые использовались для сокращения популяций нематод в почве.Корни бархатцев выделяют α-тертиенил (Gommers, Bakker, 1988; Wang et al., 2007; Faizi et al., 2011), химическое вещество, вызывающее окислительный стресс, которое эффективно проникает в гиподерму нематод и проявляет нематицидную активность (Nivsarkar et al., 2001; Hamaguchi et al., 2019). Точно так же спаржа продуцирует аспарагусную кислоту, которая ингибирует вылупление двух важных CN: Heterodera glycines и G. rostochiensis (Takasugi et al., 1975).
В растениях семейства Brassicaceae антимикробные изотиоцианаты широкого спектра действия и индолглюкозинолаты считаются соединениями, препятствующими PPN.Изотиоцианаты эффективно ингибируют отрождение CN и RKN (Brown et al., 1997; Yu et al., 2005), а также обладают токсичностью для RKN и полуэндопаразитарной нематоды Tylenchulus semipenetrans (Zasada and Ferris, 2003). В Arabidopsis синтез камалексина, фитоалексина индольного алкалоида глюкозинолатного типа, катализируется тремя цитохром P450-зависимыми монооксигеназами, CYP79B2, CYP79B3 (Hull et al., 2000; Mikkelsen et al., 2000; Bak et al. , 2001; Mikkelsen et al., 2004) и PAD3 (фитоалексин-дефицитный 3, CYP71B15). Двойные мутанты cyp79b2 / b3 , которые не накапливают индольные глюкозинолаты, более чувствительны к ХН (Shah et al., 2017), в то время как pad3 , мутанты с дефицитом камалексина более восприимчивы к RKN, чем мутанты дикого типа (Teixeira et al., 2016). Эти результаты предполагают, что некоторые индолглюкозинолаты, включая камалексин, обладают некоторым ингибирующим действием на PPN, но до сих пор не было сообщений о прямой токсичности индольных глюкозинолатов на PPN.
В дополнение к нематицидам и немастатическим соединениям, прерывание хемотаксиса PPN также может быть эффективным ответом растения на подавление или ограничение инфекции PPN. Этилен, который обычно образуется после ранения, а также во время вторжения патогенов, снижает притяжение PPN к корню (Booker and DeLong, 2015; Guan et al., 2015; Marhavý et al., 2019). Мутант Arabidopsis с избыточным продуцированием этилена менее привлекателен для PPN, а привлекательность выше у растений, обработанных ингибиторами синтеза этилена, или у нечувствительных к этилену мутантов (Fudali et al., 2013; Hu et al., 2017). Эти результаты предполагают, что инфекция PPN индуцирует выработку этилена, что, возможно, предотвращает вторичную инвазию PPN за счет снижения привлекательности. Снижение привлекательности может быть связано с уменьшением секреции аттрактантов или увеличением репеллентов. Однако молекулярная основа привлекательности PPN до сих пор в значительной степени неизвестна. Несколько групп пытались идентифицировать аттрактанты RKN по кончикам корней (Čepulytė et al., 2018) и слизистой оболочке семян (Tsai et al., 2019).Идентификация хемоаттрактантов и хеморепеллентов может дать некоторое представление о том, как растения реагируют на нематод в ризосфере как до, так и во время инфицирования PPN.
Укрепление клеточной стенки как физический барьер
Поскольку все PPN должны проникать через клеточную стенку для питания, усиление структуры клеточной стенки рассматривается как эффективная защита как физический барьер (рис. 2C). Например, инфекция PPN часто вызывает накопление лигнина в устойчивых растениях (Balhadère and Evans, 1995a; Balhadère and Evans, 1995b; Andres et al., 2001; Dhakshinamoorthy et al., 2014). Более того, мутантов Arabidopsis с повышенными уровнями сирингиллигнина снизили скорость воспроизводства M. incognita (Wuyts et al., 2006a). Эти результаты предполагают, что накопление лигнина в корнях является эффективным антагонистом инфекции PPN.
Эффективность накопления лигнина для подавления нематодной инфекции также поддерживается иммунными индукторами растений, такими как β-аминомасляная кислота (BABA), тиамин и склареол. BABA, небелковая аминокислота, обладает широкой эффективностью против вирусов, бактерий, грибов и оомицетов в различных растениях (Alexandersson et al., 2016; Коэн и др., 2016). Лечение BABA подавляет инвазию RKN, задерживает образование гигантских клеток и замедляет развитие RKN. Интересно, что BABA вызывает накопление лигнина в корнях и накопление каллозы в галлах (Ji et al., 2015). Обработка тиамином (витамином B1) также вызывает накопление лигнина в корнях; усиливает экспрессию фенилаланинаммиаклиазы, ключевого фермента пути биосинтеза фенилпропаноидов; снижает проникновение ППН; и задерживает развитие PPN (Huang et al., 2016).Ингибитор фенилаланинаммиаклиазы подавляет тиамин-опосредованный иммунитет, указывая на то, что активация фенилпропаноидного пути с последующим накоплением лигнина важна для тиамин-опосредованного иммунитета против нематод. Обработка склареолом, противомикробным соединением, активным против некоторых патогенных для растений бактерий и грибов (Bailey et al., 1975; Kennedy et al., 1992; Seo et al., 2012), также индуцирует накопление лигнина и подавляет проникновение RKN (Fujimoto и др., 2015).Важно отметить, что мутант Arabidopsis по циннамоил-коА редуктазы ( ccr2 ), дефектный по накоплению лигнина, не может индуцировать опосредованное склареолом подавление проникновения RKN, что позволяет предположить, что накопление лигнина важно для опосредованного склареолом иммунитета.
Подобно накоплению лигнина, отложение каллозы и накопление суберина также может укреплять клеточные стенки и способствовать иммунитету против PPN. RKN Meloidogyne naasi вызывает отложение каллозы на ранней стадии заражения и накопление суберина на более поздней стадии в устойчивом травяном растении Aegilops variabilis (Balhadère and Evans, 1995a; Balhadère and Evans, 1995b).Заражение Arabidopsis с помощью RKN или CN также индуцирует транскрипционную активацию генов биосинтеза суберина в месте заражения (Holbein et al., 2019). Сверхэкспрессия фактора транскрипции RAP2.6 в Arabidopsis приводит к усиленному отложению каллозы в синцитиях и приводит к более высокой устойчивости к CN (Ali et al., 2013). RAP2.6 сильно подавляется в синцитиях по сравнению с неинфицированным корнем; следовательно, возможно, что CN подавляет экспрессию RAP2.6, чтобы ингибировать отложение каллозы в синцитии.
Лигнин и суберин в ламеллах суберина и каспариевых полосах в энтодерме также являются важными базальными физическими барьерами для RKN. RKNs не способны напрямую пересекать энтодерму из-за усиления клеточных стенок субериновыми ламеллами и каспариновыми полосами (Wyss et al., 1992; Abad et al., 2009). Действительно, мутанты Arabidopsis , дефектные по каспарным полоскам, более восприимчивы к RKN (Holbein et al., 2019).
Реактивные формы кислорода (ROS)
Быстрое производство ROS, таких как супероксид-анион и перекись водорода, является консервативной сигнальной реакцией во всех царствах, а у растений оно индуцируется на ранней стадии инфекции PPN (рис. 2D). .АФК обладают прямыми антимикробными свойствами, но также служат сигнальными молекулами для активации дополнительных и дополнительных иммунных выходов, таких как укрепление клеточных стенок за счет сшивания полимеров, усиление и распространение внутри- и межклеточных защитных сигналов и регулирование гибели HR-клеток (Torres et al. , 2006; Кадота и др., 2015). Устойчивые растения томата, несущие ген Mi-1.2 , отвечают на инфекцию RKN сильной и продолжительной индукцией ROS. С другой стороны, чувствительные растения томатов имеют слабую и временную индукцию АФК в ответ на инфекцию нематод (Melillo et al., 2006; Melillo et al., 2011; Чжоу и др., 2018). Точно так же сильная продукция ROS индуцируется в корнях Arabidopsis во время несовместимых взаимодействий с CN H. glycines сои (Waetzig et al., 1999). Гистохимические исследования показали, что перекись водорода накапливается в апопласте после инфицирования авирулентных RKN или CN (Waetzig et al., 1999; Melillo et al., 2006).
Гомологи респираторного взрыва оксидазы НАДФН-оксидазы, связанные с плазматической мембраной, имеют важное значение для продукции апопластных АФК (Kadota et al., 2015). У томатов индуцированный белокрылкой 1 (WFI1), гомолог RBOH, необходим для Mi-1.2-опосредованного накопления ROS во время инфицирования RKN. Соответственно, HSFA1, фактор теплового шока класса A, который регулирует транскрипцию Wfi1 путем связывания с промотором Wfi1 , также имеет решающее значение для продукции ROS, опосредованной Mi-1.2 (Zhou et al., 2018). В Arabidopsis , который имеет 10 RBOHD, RBOHD является основным источником продукции ROS во время иммунитета, вызванного PTI и NLR. RBOHF также может дублироваться с RBOHD в некоторых ответах, потому что двойной мутант rbohD rbohF имеет более сильный фенотип защитного ответа против бактериальных патогенов (Torres and Dangl, 2005; Torres et al., 2006). Точно так же rbohD rbohF производит больше галлов после инфицирования RKN, чем дикого типа (Teixeira et al., 2016), что указывает на положительную роль продукции RBOHD и RBOHF ROS в иммунитете против RKN. Интересно, что у двойного мутанта rbohD rbohF развивается меньшее количество CN, что указывает на то, что CN требуют другого уровня контроля ROS с помощью RBOH для успешного установления инфекции. Кроме того, rbohD rbohF демонстрирует более крупные области гибели HR-клеток и меньшее образование синцития при заражении CN, что позволяет предположить, что CN используют RBOHD- и RBOHF-опосредованные ROS для подавления гибели HR-клеток в организме хозяина (Siddique et al., 2014).
Чтобы защитить себя от токсичности продуцируемых хозяином АФК, эндопаразитические нематоды могли развить ряд антиоксидантных ферментов на своей поверхности и в подкожной клетчатке (Henkle-Dührsen and Kampkötter, 2001). Например, как CN, так и RKN продуцируют пероксиредоксины; некоторые из наиболее распространенных детоксифицирующих антиоксидантных ферментов, которые удаляют перекись водорода из апопласта растений-хозяев за счет тиоредоксина (TRX) цистеин-тиол-дисульфидного обмена (Robertson et al., 2000; Henkle-Dührsen and Kampkötter, 2001; Dubreuil et al., 2011). PRX2.1, пероксиредоксин клады B в M. incognita , экспрессируется при инфицировании, и нокдаун гена снижает устойчивость к окислительному стрессу, что приводит к меньшему количеству галлов. Это взаимодействие предполагает критическую роль PRX2.1 в инфекции. CN также секретируют GPX-1, вариант глутатионпероксидазы, из гиподермы, чтобы улавливать производные хозяина ROS, тем самым защищая внешние клеточные мембраны от окисления (Jones et al., 2004). M. incognita глутатион-S-трансферазы доставляются в апопласт хозяина для детоксикации продуктов окислительного стресса (Dubreuil et al., 2007). Действительно, только что вылупившиеся инфекционные молодые особи M. incognita гораздо более устойчивы к экзогенной обработке перекисью водорода, чем C. elegans (Isermann et al., 2004).
Другой стратегией PPN для защиты от ROS хозяина является активация системы удаления ROS хозяина путем секреции эффекторов вирулентности. Например, эффектор CN 10A06 взаимодействует со спермидинсинтазой 2 хозяина и увеличивает содержание спермидина в инфицированных тканях (Hewezi et al., 2010). Спермидин в более высоких концентрациях действует как поглотитель АФК, а в более низких концентрациях он косвенно снижает окислительный стресс, активируя клеточные антиоксидантные системы (Kasukabe et al., 2004). Действительно, эктопическая экспрессия 10A06 в Arabidopsis увеличивает экспрессию нескольких генов, кодирующих антиоксидантные ферменты. Точно так же MjTTL5, эффектор вирулентности из M. javanica , взаимодействует с каталитической субъединицей (FTRc) ферредоксина Arabidopsis : TRX-редуктаза (FTRc) в пластидах (Lin et al., 2016). FTR активирует TRX в хлоропластах или пластидах, получая восстанавливающие эквиваленты из восстановленного ферредоксина (Balmer et al., 2006; Kirchsteiger et al., 2012). Взаимодействие MjTTL5 с FTRc резко увеличивает активность хозяина по улавливанию ROS, таким образом модулируя иммунную реакцию растений. Поскольку пероксиредоксины используют TRX для восстановления перекиси водорода (Broin et al., 2002; Kotze, 2003), возможно, что FTRc частично работает с пероксиредоксинами, обеспечивая восстановленный TRX для снижения продукции ROS в растениях.
Оксид азота (NO) и иммунитет на основе ингибиторов протеаз
NO является важной сигнальной молекулой, выполняющей множество функций в растениях (Delledonne et al., 1998; Torres et al., 2006; Bellin et al., 2013; Mur et al., 2013; Scheler et al., 2013) (рисунок 2E). После заражения M. incognita устойчивые растения томата, несущие Mi-1.2 , производят больше NO, чем чувствительные сорта (Melillo et al., 2011). Применение экзогенного донора NO, нитропруссида натрия (SNP), на чувствительные растения томатов значительно усиливает иммунитет против RKN (Zhou et al., 2015). Лечение SNP снижает количество яичных масс и восстанавливает ингибирование роста, связанное с PPN, что позволяет предположить, что NO играет положительную роль в иммунитете. NO может участвовать в JA-зависимом пути защиты RKN, поскольку поглотитель NO частично ингибирует JA-индуцированные защитные реакции RKN. Более того, ингибирование биосинтеза JA химическими ингибиторами значительно увеличивало восприимчивость к RKN, но устойчивость эффективно восстанавливалась путем применения экзогенных SNP. Поскольку как JA-, так и SNP-индуцированные защитные реакции RKN скомпрометированы из-за подавления ингибитора протеазы 2 ( PI2 ), NO- и JA-пути, вероятно, сходятся, чтобы индуцировать иммунитет против PPN (Zhou et al., 2015). Однако остается неясным, какие протеазы ингибирует PI2. Поскольку PPN используют различные протеазы для своей вирулентности и для своего развития (Urwin et al., 1997; Neveu et al., 2003), эти активности могут подавляться PI2. Интересно, что гетерологичная экспрессия различных ингибиторов протеаз, включая ингибиторы трипсина и ингибиторы цистеиновых протеаз, придает устойчивость к PPN, показывая эффективность основанного на ингибиторе протеазы иммунитета против PPN (Hepher and Atkinson, 1992; Urwin et al., 2000; Urwin et al., 2003).
Ингибирование развития нематод на основе смерти HR-клеток
Гибель HR-клеток, тип запрограммированной гибели клеток, которая индуцируется после вторжения авирулентных патогенов для предотвращения распространения биотрофных патогенов (Huysmans et al., 2017), также играет решающую роль в иммунитете PPN (рис. 2F). Гибель HR-клеток наблюдалась на трех различных фазах инфицирования PPN у устойчивых растений: (1) в коре и эпидермисе во время проникновения и миграции PPN (Hung and Rohde, 1973; Thomason et al., 1976; Финетти Сиалер, 1990; Бальхадер и Эванс, 1995b; Пегард и др., 2005; Proite et al., 2008; Альбукерке и др., 2010; Khallouk et al., 2011; Cabasan et al., 2014; Davies et al., 2015a), (2) в тканях сосудов во время инициирования образования питающих клеток (Paulson and Webster, 1972; Melillo et al., 2006) и (3) в клетках, прилегающих к развивающимся питающим клеткам (Kim et al. al., 1987; Rice et al., 1987; Sobczak et al., 2005; Kim et al., 2010; Kim et al., 2012; Cabasan et al., 2014; Seo et al., 2014; Ye et al. ., 2017).
Во время проникновения и миграции PPN гибель клеток также часто наблюдается у восприимчивых растений, но она менее быстрая и менее частая, чем у устойчивых сортов (Endo and Veech, 1970; Thomason et al., 1976; Sobczak et al., 2005). ). Смерть HR-клеток может ингибировать миграцию нематод, но неясно, останавливает ли смерть HR-клеток движение PPN напрямую, или косвенно за счет высвобождения немастатических или нематицидных химических веществ или DAMP для активации других иммунных ответов. Гибель HR-клеток также индуцируется во время инициации развития питающих клеток.Например, Mi-1.2 -устойчивые растения томата индуцируют гибель HR-клеток во время индукции RKN гигантских клеток, тем самым подавляя развитие питающихся клеток (Paulson and Webster, 1972; Melillo et al., 2006). Другой возможной функцией гибели HR-клеток является создание физического разрыва между питающимися клетками и окружающими клетками для блокировки подачи питательных веществ и воды. Например, в устойчивых линиях томатов, несущих ген Hero , CN картофеля ( G. rostochiensis ) образует синцитии, но гибель HR-клеток индуцируется в окружающих клетках, что приводит к отделению синцития от проводящих тканей стеляра ( Собчак и др., 2005). Отключение питающих клеток от окружающей ткани также происходит у устойчивых растений после заражения RKNs (Seo et al., 2014; Ye et al., 2017). Диссоциация окружающей ткани приводит к плохому снабжению питательными веществами, тем самым подавляя рост или вызывая гибель питающихся клеток, снижая плодовитость самок и ускоряя развитие самцов (Acedo et al., 1984; Rice et al., 1987; Kouassi et al., 2004; Собчак и др., 2005). Повышенное развитие самцов совпадает с уменьшением количества самок, что приводит к уменьшению яиц PPN.У некоторых устойчивых растений также индуцируется гибель питающихся клеток без гибели HR-клеток окружающих клеток. Например, гибель синцитий индуцируется у устойчивых соевых бобов (Yan and Baidoo, 2018), а разрушение гигантских клеток индуцируется в устойчивом вигне, несущем ген Rk , без типичной гибели HR-клеток в окружающих клетках (Das et al., 2008). ). Эти различия в сайте инициации гибели HR-клеток могут зависеть от конкретного паттерна экспрессии генов хозяина R (Yan and Baidoo, 2018) и эффекторов PPN.
Важность гибели HR-клеток подтверждается наблюдением, что и RKN, и CN имеют эффекторы, которые подавляют гибель HR-клеток. Эффектор M. incognita MiISE5, белок цинкового пальца, подавляет гибель HR-клеток, вызванную бактериальным патогеном, не являющимся хозяином, Burkholderia glumae в N. benthamiana , возможно, посредством перепрограммирования транскриптома хозяина (Shi et al. др., 2018). Эффектор MeTCTP RKN из Meloidogyne enterolobii также подавляет гибель HR-клеток, запускаемую проапоптотическим белком мыши, Bcl2-ассоциированным X-белком (Zhuo et al., 2017). CN также имеют эффекторы подавления смерти HR-клеток, такие как эффекторы SPRYSEC (Ali et al., 2015b), RHA1B, убиквитинлигаза E3 (Kud et al., 2019) и GrEXPB2, экспансиноподобный белок (Ali et al. , 2015а). Однако эти эффекторы CN не ингибируют специфически гибель HR-клеток, но также ингибируют другие защитные реакции.
Выводы и направления на будущее
В результате идентификации нескольких рецепторов типа NLR и PRR, участвующих в иммунитете против PPN, мы постепенно начали понимать, как растения распознают нематодную инфекцию и реагируют на нее на молекулярном уровне.Однако эффекторы PPN и PAMP все еще в значительной степени неизвестны, и соответствующие рецепторы остаются неидентифицированными. Точно так же были выявлены различные иммунные ответы против нематод в широком диапазоне устойчивых сельскохозяйственных культур и модельных растений (рис. 2 и дополнительная таблица 1), но все еще многое неизвестно между феноменом распознавания PPN и запуском специфических иммунных ответов. (Рисунок 3). Таким образом, значительные проблемы для будущих исследований в области взаимодействий растений и нематод будут заключаться в выявлении пар иммунный рецептор-лиганды (PAMP, DAMP и эффекторы), в уточнении молекулярных основ сигнальных путей, ведущих к индивидуальным иммунным ответам, для понимания взаимодействия этих компонентов и сигнальных путей в иммунитете к PPN, а также для идентификации молекулярных компонентов, которые определяют специфичность хозяина.Потеря значительной сельскохозяйственной продуктивности среди растущего населения мира выходит за рамки денежных потерь. Отсутствие действительно эффективных стратегий борьбы с популяциями нематод и инфекциями имеет серьезные и ухудшающиеся последствия для устойчивого сельского хозяйства. Понимание молекулярных механизмов распознавания PPN и иммунных сигнальных сетей обеспечит базу знаний для столь необходимых стратегий борьбы с PPN в будущем.
Рисунок 3 Взаимосвязь между распознаванием нематод и иммунными ответами Растения активируют иммунитет, запускаемый паттерном, и иммунитет, запускаемый NLR, против инфекции PPN, используя различные иммунные рецепторы.Эти рецепторы запускают множество защитных реакций. Некоторые иммунные ответы, такие как продукция ROS / NO, индуцируются совместно некоторыми иммунными рецепторами с разной кинетикой, тогда как другие ответы, такие как гибель клеток, индуцируются специфическими иммунными рецепторами.
Вклад авторов
Все перечисленные авторы внесли существенный, прямой и интеллектуальный вклад в работу и одобрили ее для публикации.
Финансирование
Эта работа была поддержана Grant-in-Aid для гранта для стипендиатов JSPS номер JP19J00655 (для KSa), и номер гранта MEXT / JSPS KAKENHI, JP16H06186, JP16KT0037 и JP19H02962 (для YK5956, JP15H и JP15H02962 (для YK5956), JP15H ).
Конфликт интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Сокращения
BABA, β-аминомасляная кислота; CC, спиральный; CN — Кистовая нематода; FTR, ферредоксин: тиоредоксинредуктаза; ЧСС, гиперчувствительный ответ; JA, жасмоновая кислота; LRR, богатый лейцином повтор; NLR, лейцин-богатый повтор нуклеотид-связывающего домена; NO, оксид азота; OG, олигогалактурониды; PAMP, молекулярный паттерн, связанный с патогенами; PG, полигалактуроназа; PGIP, белки-ингибиторы полигалактуроназы; PLCP, папаин-подобная цистеиновая протеаза; ППН, нематода, паразитирующая на растениях; PRR, рецептор распознавания образов; PTI, иммунитет, управляемый паттерном; RBOH, гомолог оксидазы респираторного взрыва; РКН — узловатая нематода; RLK, рецептор-подобная киназа; АФК, активные формы кислорода; СНП, нитропруссид натрия; SPRYSEC, секретируемый SP1a и домен рианодинового рецептора (SPRY); TIR, рецептор толл-интерлейкина 1; TRX, тиоредоксин.
Благодарности
Мы благодарим всех членов лаборатории Ширасу в RIKEN и доктора Такето Уэхара из Центрального регионального центра сельскохозяйственных исследований, НАРО за плодотворные обсуждения этого обзора. Из-за нехватки места было процитировано ограниченное количество исследований. Мы признаем важный вклад многих других ученых в понимание реакции растений на нематодную инфекцию и поэтому приносим извинения всем нашим коллегам, на работы которых здесь нет ссылок.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https: // www.frontiersin.org/articles/10.3389/fpls.2019.01165/full#supplementary-material
Ссылки
Абад П., Кастаньоне-Серено П., Россо М. Н., Энглер Дж. Д. А., Фавери Б. (2009). «Нашествие, питание и развитие» в Узловых нематод . Ред. Перри, Р. Н., Моэн, М., Старр, Дж. Л. (Кембридж: CABI International Press), 163–181. doi: 10.1079 / 9781845934927.0163
CrossRef Полный текст | Google Scholar
Acedo, J. R., Dropkin, V. H., Luedders, V. D.(1984). Истощение популяции нематод и гистопатология ассоциаций Heterodera glycines -соевых бобов. J. Nematol. 16 (1), 48–56.
PubMed Аннотация | Google Scholar
Albuquerque, E., Carneiro, R., Costa, P., Gomes, A., Santos, M., Pereira, A., et al. (2010). Устойчивость к Meloidogyne incognita вызывает гиперчувствительную реакцию у Coffea arabica . евро. J. Plant Pathol. 127 (3), 365–373. doi: 10.1007 / s10658-010-9603-3
CrossRef Полный текст | Google Scholar
Александерссон, Э., Мулугета, Т., Ланкинен, Э., Лильерот, Э., Андреассон, Э. (2016). Индукторы устойчивости растений к патогенам у видов Solanaceae — от молекулярных механизмов до применения в полевых условиях. Внутр. J. Mol. Sci. 17 (10), 1673. doi: 10.3390 / ijms17101673
CrossRef Полный текст | Google Scholar
Али, М. А., Аббас, А., Крейл, Д. П., Больманн, Х. (2013). Сверхэкспрессия фактора транскрипции RAP2.6 приводит к усиленному отложению каллозы в синцитиях и повышенной устойчивости против нематоды цист свеклы Heterodera schachtii в корнях Arabidopsis. BMC Plant Biol. 13, 47. doi: 10.1186 / 1471-2229-13-47
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Али, С., Магне, М., Чен, С., Кот, О., Старе, Б. Г., Обрадович, Н. и др. (2015a). Анализ предполагаемых апопластных эффекторов нематоды Globodera rostochiensis и идентификация экспансиноподобного белка, который может индуцировать и подавлять защиту хозяина. PLoS One 10 (1), e0115042. doi: 10.1371 / journal.pone.0115042
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Али, С., Магне, М., Чен, С., Обрадович, Н., Джамшайд, Л., Ван, X. и др. (2015b). Анализ эффекторов Globodera rostochiensis выявил консервативные функции белков SPRYSEC в подавлении и индукции иммунных ответов растений. Фронт. Plant Sci. 6, 623. doi: 10.3389 / fpls.2015.00623
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Андрес, М. Ф., Мелилло, М. Т., Делибес, А., Ромеро, М. Д., Блеве-Зачео, Т. (2001). Изменения ферментов корней пшеницы коррелировали с устойчивостью к нематодам злаков. New Phytol. 152 (2), 343–354. doi: 10.1111 / j.0028-646X.2001.00258.x
CrossRef Полный текст | Google Scholar
Bagnaresi, P., Sala, T., Irdani, T., Scotto, C., Lamontanara, A., Beretta, M., et al. (2013). Solanum torvum ответы на корневую нематоду Meloidogyne incognita . BMC Genomics 14, 540. doi: 10.1186 / 1471-2164-14-540
PubMed Реферат | CrossRef Полный текст | Google Scholar
Bailey, J., Carter, G., Бёрден Р., Уэйн Р. (1975). Борьба с болезнями ржавчины дитерпенами из Nicotiana glutinosa . Nature 255 (5506), 328–329. doi: 10.1038 / 255328a0
CrossRef Полный текст | Google Scholar
Bak, S., Tax, F. E., Feldmann, K. A., Galbraith, D. W., Feyereisen, R. (2001). CYP83B1, цитохром P450 в точке метаболического разветвления в биосинтезе ауксина и индолглюкозинолата у Arabidopsis. Растительная клетка 13 (1), 101–111. doi: 10.1105 / tpc.13.1.101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Болдридж, Г.Д., О’Нил, Н. Р., Самак, Д. А. (1998). Устойчивость люцерны ( Medicago sativa L.) к нематоде, поражающей корни, Pratylenchus Penetrans : мРНК гена защитного ответа и уровни изофлавоноидного фитоалексина в корнях. Завод Мол. Биол. 38 (6), 999–1010. doi: 10.1023 / A: 10061828
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Balhadère, P., Evans, A. (1995a). Цитохимическое исследование устойчивости к узловатой нематоде Meloidogyne naasi в зерновых и злаках с использованием криосрезов корней. Фонд. Прил. Нематол. 18 (6), 539–547.
Google Scholar
Balhadère, P., Evans, A. (1995b). Гистопатогенез чувствительных и устойчивых ответов пшеницы, ячменя и диких трав на Meloidogyne naasi. Фонд. Прил. Нематол. 18 (6), 531–538.
Google Scholar
Балмер, Ю., Вензель, В. Х., Кай, Н., Маньери, В., Шюрманн, П., Херкман, В. Дж. И др. (2006). Полная система ферредоксин / тиоредоксин регулирует основные процессы в амилопластах. Proc. Natl. Акад. Sci. США 103 (8), 2988–2993. DOI: 10.1073 / pnas.0511040103
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Беллин, Д., Асаи, С., Делледон, М., Йошиока, Х. (2013). Оксид азота как посредник защитных реакций. Мол. Взаимодействие с растительными микробами. 26 (3), 271–277. doi: 10.1094 / MPMI-09-12-0214-CR
PubMed Реферат | CrossRef Полный текст | Google Scholar
Benedetti, M., Pontiggia, D., Raggi, S., Cheng, Z., Scaloni, F., Ferrari, S., et al. (2015). Иммунитет растений запускается сконструированным in vivo высвобождением олигогалактуронидов, молекулярными структурами, связанными с повреждениями. Proc. Natl. Акад. Sci. США 112 (17), 5533–5538. DOI: 10.1073 / pnas.1504154112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бишоп П. Д., Макус Д. Дж., Пирс Г., Райан К. А. (1981). Активность фактора, индуцирующего ингибитор протеиназы, в листьях томата заключается в олигосахаридах, ферментативно высвобождаемых из клеточных стенок. Proc. Natl. Акад. Sci. США 78 (6), 3536–3540. doi: 10.1073 / pnas.78.6.3536
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Blanchard, A., Esquibet, M., Fouville, D., Grenier, E. (2005). Ranbpm генов-гомологов, характерных для цистовых нематод Globodera pallida и Globodera ‘mexicana’ . Physiol. Мол. Завод Патол. 67 (1), 15–22. doi: 10.1016 / j.pmpp.2005.09.001
CrossRef Полный текст | Google Scholar
Bohlmann, H.(2015). «Вводная глава по основам биологии цистовых нематод» в Взаимодействие с нематодами растений: взгляд на совместимые взаимосвязи, том 73, Успехи в ботанических исследованиях . Ред. Эскобар, К., Фенолл, К. (Оксфорд, Великобритания: Elsevier), 33–60. doi: 10.1016 / bs.abr.2014.12.001
CrossRef Полный текст | Google Scholar
Букер М. А., Делонг А. (2015). Производство этиленового сигнала: регуляция и диверсификация ферментов биосинтеза этилена. Plant Physiol. 169 (1), 42–50. doi: 10.1104 / pp.15.00672
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Boutrot, F., Zipfel, C. (2017). Функция, открытие и использование рецепторов распознавания образов растений для устойчивости к болезням широкого спектра. Annu. Rev. Phytopathol. 55, 257–286. doi: 10.1146 / annurev-phyto-080614-120106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Broin, M., Cuiné, S., Eymery, F., Rey, P. (2002). Пластидный 2-цистеинпероксиредоксин является мишенью для тиоредоксина, участвующего в защите фотосинтетического аппарата от окислительного повреждения. Растительная клетка 14 (6), 1417–1432. doi: 10.1105 / tpc.001644
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Браун, П. Д., Морра, М. Дж., Спаркс, Д. Л. (1997). Борьба с почвенными вредителями растений с использованием растений, содержащих глюкозинолаты. Adv. Агрон. 61, 167–231. doi: 10.1016 / S0065-2113 (08) 60664-1
CrossRef Полный текст | Google Scholar
Cabasan, M., Kumar, A., Bellafiore, S., De Waele, D. (2014). Гистопатология рисовой нематоды корневого узелка, Meloidogyne graminicola , на Oryza sativa и O.glaberrima . Нематология 16, 73–81. doi: 10.1163 / 15685411-00002746
CrossRef Полный текст | Google Scholar
Чепулите, Р., Данкуа, В. Б., Брюнинг, Г., Уильямсон, В. М. (2018). Мощный аттрактант для нематод, вызывающих завязку, в экссудатах кончиков корней проростков двух видов-хозяев. Sci. Rep. 8 (1), 10847. doi: 10.1038 / s41598-018-29165-4
PubMed Реферат | CrossRef Полный текст | Google Scholar
Chen, J., Hu, L., Sun, L., Lin, B., Хуанг К., Чжо К. и др. (2018). Новый эффектор Meloidogyne graminicola , MgMO237, взаимодействует с множеством белков, связанных с защитой хозяина, чтобы влиять на базальный иммунитет растений и способствовать паразитизму. Мол. Завод Патол. 19 (8), 1942–1955. doi: 10.1111 / mpp.12671
CrossRef Полный текст | Google Scholar
Chen, R., Li, H., Zhang, L., Zhang, J., Xiao, J., Ye, Z. (2007). CaMi , ген устойчивости к корневым нематодам из острого перца ( Capsium annuum L.) придает помидорам устойчивость к нематодам. Plant Cell Rep. 26 (7), 895–905. doi: 10.1007 / s00299-007-0304-0
PubMed Реферат | CrossRef Полный текст | Google Scholar
Chen, S., Chronis, D., Wang, X. (2013). Новый пептид GrCEP12 из паразитарных растений нематоды Globodera rostochiensis подавляет flg22-опосредованный PTI. Сигнальное поведение растений. 8 (9), e25359. doi: 10.4161 / psb.25359
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чин, С., Бем, К. А., Матесиус, У. (2018). Функции флавоноидов во взаимодействиях растение – нематода. Растения (Базель) 7 (4), 85. doi: 10.3390 / Растения7040085
CrossRef Полный текст | Google Scholar
Кларк, А. Дж., Кокс, П. М., Шеперд, А. М. (1967). Химический состав скорлупы яиц цист-нематоды картофеля, Heterodera rostochiensis Woll. Biochem. J. 104 (3), 1056–1060. doi: 10.1042 / bj1041056
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Claverie, M., Дирлевангер, Э., Босселут, Н., Ван Гелдер, К., Вуазен, Р., Кляйнхентц, М., и др. (2011). Ген Ma полного спектра устойчивости к видам Meloidogyne в Prunus представляет собой TNL с огромной повторяющейся C-концевой пост-LRR областью. Plant Physiol. 156 (2), 779–792. DOI: 10.1104 / pp.111.176230
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коэн, Ю., Вакнин, М., Маух-Мани, Б. (2016). BABA-индуцированная резистентность: основные этапы 55-летнего пути. Phytoparasitica 44 (4), 513–538. doi: 10.1007 / s12600-016-0546-x
CrossRef Полный текст | Google Scholar
Цуй, Х., Цуда, К., Паркер, Дж. Э. (2015). Иммунитет, запускаемый эффектором: от восприятия патогенов до надежной защиты. Annu. Rev. Plant Biol. 66, 487–511. doi: 10.1146 / annurev-arplant-050213-040012
PubMed Реферат | CrossRef Полный текст | Google Scholar
D’Addabbo, T., Carbonara, T., Argentieri, M., Radicci, V., Leonetti, P., Вилланова Л. и др. (2013). Нематицидный потенциал Artemisia annua и его основных метаболитов. евро. J. Plant Pathol. 137 (2), 295–304. doi: 10.1007 / s10658-013-0240-5
CrossRef Полный текст | Google Scholar
D’Ovidio, R., Mattei, B., Roberti, S., Bellincampi, D. (2004). Полигалактуроназы, белки, ингибирующие полигалактуроназу, и пектиновые олигомеры во взаимодействиях между растениями и патогенами. Биохим. Биофиз. Acta 1696 (2), 237–244. DOI: 10.1016 / j.bbapap.2003.08.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Das, S., DeMason, D., Ehlers, J., Close, T., Roberts, P. (2008). Гистологическая характеристика устойчивости к узловатым нематодам вигны и ее связь с модуляцией активных форм кислорода. J. Exp. Бот. 59 (6), 1305–1313. doi: 10.1093 / jxb / ern036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дэвис, Л. Дж., Браун, К. Р., Эллинг, А. А. (2015a). Кальций участвует в опосредованном R Mc1 (blb) гиперчувствительном ответе против Meloidogyne chitwoodi в картофеле. Plant Cell Rep. 34 (1), 167–177. doi: 10.1007 / s00299-014-1697-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дэвис, Л. Дж., Чжан, Л., Эллинг, А. А. (2015b). Arabidopsis thaliana папаин-подобная цистеиновая протеаза RD21 взаимодействует с эффекторным белком корневых нематод. Нематология 17 (6), 655–666. doi: 10.1163 / 15685411-00002897
CrossRef Полный текст | Google Scholar
Дэвис, Э. Л., Хасси, Р. С., Митчум, М.Г., Баум Т. Дж. (2008). Белки паразитизма во взаимодействиях нематод и растений. Curr. Opin. Plant Biol. 11 (4), 360–366. doi: 10.1016 / j.pbi.2008.04.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Decraemer, W., Hunt, D. J. (2013). «Структура и классификация», в нематологии растений , 2 изд. Ред. Перри, Р. Н., Моенс, М. (Уоллингфорд, Великобритания: CABI Publishing), 3–39. doi: 10.1079 / 9781780641515.0003
CrossRef Полный текст | Google Scholar
de-Deus Barbosa, A.Э. А., Роча, Ф. Р., де Лима и Соуза, Д. Д. С., Фрейре, Э., де Оливейра Нето, О. Б., Виана, А. А. Б. и др. (2009). Дифференциально экспрессируемые гены в генотипах хлопчатника, инфицированных Meloidogyne incognita . Plant Sci. 177 (5), 492–497. doi: 10.1016 / j.plantsci.2009.07.013
CrossRef Полный текст | Google Scholar
Dhakshinamoorthy, S., Mariama, K., Elsen, A., De Waele, D. (2014). Фенолы и лигнин участвуют в защитной реакции растений банана ( Musa ) на инфекцию Radopholus similis . Нематология 16, 565–576. doi: 10.1163 / 15685411-00002788
CrossRef Полный текст | Google Scholar
Dubreuil, G., Deleury, E., Magliano, M., Jaouannet, M., Abad, P., Rosso, M. N. (2011). Пероксиредоксины из паразитической узловатой нематоды растений, Meloidogyne incognita , необходимы для успешного развития в организме хозяина. Внутр. J. Parasitol. 41 (3-4), 385–396. doi: 10.1016 / j.ijpara.2010.10.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Dubreuil, G., Мальяно, М., Делери, Э., Абад, П., Россо, М. Н. (2007). Транскриптомный анализ функций корневых нематод, индуцированных на ранних стадиях паразитизма. New Phytol. 176 (2), 426–436. doi: 10.1111 / j.1469-8137.2007.02181.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Endo, B., Veech, J. (1970). Морфология и гистохимия корней сои, инфицированных Heterodera glycines . Фитопатология 60 (10), 1493–1498. DOI: 10.1094 / Phyto-60-1493
CrossRef Полный текст | Google Scholar
Эрнст К., Кумар А., Криселейт Д., Клоос Д. У., Филлипс М. С., Ганал М. В. (2002). Ген устойчивости к картофельным нематодам широкого спектра действия ( Hero ) из томатов является единственным членом большого семейства генов NBS-LRR с необычным аминокислотным повтором в области LRR. Plant J. 31 (2), 127–136. doi: 10.1046 / j.1365-313X.2002.01341.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эскобар, К., Баркала, М., Кабрера, Дж., Фенолл, К. (2015). «Обзор корневых нематод и гигантских клеток», в Взаимодействие с нематодами растений: взгляд на совместимые взаимосвязи, том 73, Успехи в ботанических исследованиях . Ред. Эскобар, К., Фенолл, К. (Оксфорд, Великобритания: Elsevier), 1–32. doi: 10.1016 / bs.abr.2015.01.001
CrossRef Полный текст | Google Scholar
Faizi, S., Fayyaz, S., Bano, S., Iqbal, E. Y., Lubna, Siddiqi, H., et al. (2011). Выделение нематицидных соединений из Tagetes patula L.желтые цветы: исследования взаимосвязи между структурой и активностью в отношении цистовой нематоды Heterodera zeae личинок инфекционной стадии. J. Agric. Food Chem. 59 (17), 9080–9093. doi: 10.1021 / jf201611b
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Finetti Sialer, M. (1990). Гистопатологические изменения, вызванные Nacobbus aberrans устойчивых и чувствительных корней картофеля. Rev. Nématol. 13 (2), 155–160.
Google Scholar
Фудали, С.Л., Ван, К., Уильямсон, В. М. (2013). Этиленовый сигнальный путь модулирует привлекательность корней-хозяев для узловатой нематоды Meloidogyne hapla . Мол. Взаимодействие с растительными микробами. 26 (1), 75–86. doi: 10.1094 / MPMI-05-12-0107-R
PubMed Реферат | CrossRef Полный текст | Google Scholar
Fujimoto, T., Mizukubo, T., Abe, H., Seo, S. (2015). Склареол индуцирует устойчивость растений к корневым нематодам частично за счет этилен-зависимого усиления накопления лигнина. Мол. Взаимодействие с растительными микробами. 28 (4), 398–407. doi: 10.1094 / MPMI-10-14-0320-R
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Глисон, К. А., Лю, К. Л., Уильямсон, В. М. (2008). Выключение эффекторного гена нематод-кандидата, соответствующего гену устойчивости томатов Mi-1 , приводит к приобретению вирулентности. Мол. Взаимодействие с растительными микробами. 21 (5), 576–585. doi: 10.1094 / MPMI-21-5-0576
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Gommers, F.Дж., Баккер Дж. (1988). Механизм действия альфа-тертиенила и родственных ему соединений может объяснить подавляющее действие видов Tagetes на популяции свободноживущих эндопаразитических нематод растений. Bioact. Мол. 7, 61–69.
Google Scholar
Goverse, A., Smant, G. (2014). Активация и подавление врожденного иммунитета растений паразитическими нематодами. Annu. Rev. Phytopathol. 52, 243–265. doi: 10.1146 / annurev-phyto-102313-050118
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гуань, Р., Su, J., Meng, X., Li, S., Liu, Y., Xu, J., et al. (2015). Многослойная регуляция индукции этилена играет положительную роль в устойчивости Arabidopsis против Pseudomonas syringae . Plant Physiol. 169 (1), 299–312. doi: 10.1104 / pp.15.00659
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hölscher, D., Dhakshinamoorthy, S., Alexandrov, T., Becker, M., Bretschneider, T., Buerkert, A., et al. (2014). Фитоалексины феналенонового типа опосредуют устойчивость растений банана ( Musa spp.) роющей нематоде Radopholus similis . Proc. Natl. Акад. Sci. США 111 (1), 105–110. DOI: 10.1073 / pnas.1314168110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хан, М. Г., Дарвилл, А. Г., Альберсхайм, П. (1981). Взаимодействие патоген-хозяин: XIX. Эндогенный элиситор, фрагмент полисахарида клеточной стенки растений, который вызывает накопление фитоалексина в соевых бобах. Plant Physiol. 68 (5), 1161–1169. DOI: 10.1104 / стр.68.5.1161
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hamaguchi, T., Sato, K., Vicente, C. S. L., Hasegawa, K. (2019). Нематицидное действие экссудата календулы α-тертиенил: соединение, вызывающее окислительный стресс, проникает в гиподерму нематод. Biol. Откройте 8 (4) (bio038646). doi: 10.1242 / bio.038646
CrossRef Полный текст | Google Scholar
Хефер, А., Аткинсон, Х. Дж. (1992). Контроль нематод с помощью ингибиторов протеиназ. EP 0502730 B1.
Google Scholar
Hewezi, T., Howe, P. J., Maier, T. R., Hussey, R. S., Mitchum, M. G., Davis, E. L., et al. (2010). Спермидинсинтаза арабидопсиса нацелена на эффекторный белок цистовой нематоды Heterodera schachtii . Plant Physiol. 152 (2), 968–984. doi: 10.1104 / pp.109.150557
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Holbein, J., Franke, R. B., Marhavý, P., Fujita, S., Górecka, M., Sobczak, M., et al.(2019). Энтодермальная барьерная система корня способствует защите от паразитарных кист и нематод корневых узлов. Завод J . doi: 10.1111 / tpj.14459
CrossRef Полный текст | Google Scholar
Ху, Ю., Ю, Дж., Ли, К., Уильямсон, В. М., Ван, К. (2017). Путь ответа на этилен регулирует привлекательность корней растений для нематоды цист сои Heterodera glycines . Sci. Rep. 7, 41282. doi: 10.1038 / srep41282
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хуанг, Дж.С., Баркер К. Р. (1991). Глицеоллин I во взаимодействиях соевых бобов и нематод: пространственное и временное распределение в корнях устойчивых и восприимчивых соевых бобов. Plant Physiol. 96 (4), 1302–1307. doi: 10.1104 / pp.96.4.1302
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хуанг, В. К., Цзи, Х. Л., Гейзен, Г., Киндт, Т. (2016). Индуцированное тиамином праймирование против инфекции корневых нематод риса включает лигнификацию и образование перекиси водорода. Мол.Завод Патол. 17 (4), 614–624. doi: 10.1111 / mpp.12316
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hull, A. K., Vij, R., Celenza, J. L. (2000). Arabidopsis цитохромов P450, которые катализируют первую стадию триптофан-зависимого биосинтеза индол-3-уксусной кислоты. Proc. Natl. Акад. Sci. U S A 97 (5), 2379–2384. doi: 10.1073 / pnas.040569997
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hung, C., Rohde, R.А. (1973). Накопление фенола связано с устойчивостью томатов к заражению нематодами корневых узлов и поражениями. J. Nematol. 5 (4), 253–258.
PubMed Аннотация | Google Scholar
Хьюисманс, М., Лема, А., С., Колл, Н. С., Новак, М. К. (2017). Две смерти — запрограммированная регуляция гибели клеток в процессе развития и болезни. Curr. Opin. Plant Biol. 35, 37–44. doi: 10.1016 / j.pbi.2016.11.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Изерманн, К., Либау, Э., Редер, Т., Брухауз, И. (2004). Пероксиредоксин, специфически экспрессируемый в двух типах нейронов глотки, необходим для нормального роста и производства яиц у Caenorhabditis elegans . J. Mol. Биол. 338 (4), 745–755. doi: 10.1016 / j.jmb.2004.03.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Jablonska, B., Ammiraju, J. S., Bhattarai, K. K., Mantelin, S., Martinez de Ilarduya, O., Roberts, P. A., et al. (2007). Ген Mi-9 из Solanum arcanum , придающий термостойкость нематодам корневого узла, является гомологом Mi-1 . Plant Physiol. 143 (2), 1044–1054. doi: 10.1104 / pp.106.089615
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Jaouannet, M., Magliano, M., Arguel, M. J., Gourgues, M., Evangelisti, E., Abad, P., et al. (2013). Морская нематода кальретикулин Mi-CRT является ключевым эффектором в подавлении защиты растений. Мол. Взаимодействие с растительными микробами. 26 (1), 97–105. doi: 10.1094 / MPMI-05-12-0130-R
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ji, H., Киндт, Т., Хе, В., Ванхольм, Б., Гейзен, Г. (2015). Вызванная β-аминомасляной кислотой резистентность риса к нематодам, вызывающим завязку корня, основана на повышенной базовой защите. Мол. Взаимодействие с растительными микробами. 28 (5), 519–533. doi: 10.1094 / MPMI-09-14-0260-R
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Jones, J. T., Haegeman, A., Danchin, E. G., Gaur, H. S., Helder, J., Jones, M. G., et al. (2013). Топ-10 нематод, паразитирующих на растениях, в молекулярной патологии растений. Мол.Завод Патол. 14 (9), 946–961. doi: 10.1111 / mpp.12057
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джонс, Дж. Т., Риви, Б., Смант, Г., Прайор, А. Э. (2004). Глутатионпероксидазы цистовой нематоды картофеля Globodera rostochiensis . Gene 324, 47–54. doi: 10.1016 / j.gene.2003.09.051
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Калошян И., Десмонд О. Дж., Атамиан Х. С. (2011). «Гены устойчивости к болезням и защитные реакции при несовместимых взаимодействиях» в Геномика и молекулярная генетика взаимодействий растений и нематод .Ред. Джонс, Дж., Гейзен, Г., Фенолл, К. (Дордрехт, Нидерланды: Springer), 309–324. doi: 10.1007 / 978-94-007-0434-3_15
CrossRef Полный текст | Google Scholar
Каплан, Д. Т., Кин, Н. Т., Томасон, И. Дж. (1980). Ассоциация глицеоллина с несовместимой реакцией корней сои на Meloidogyne incognita . Physiol. Завод Патол. 16 (3), 309–318. doi: 10.1016 / S0048-4059 (80) 80002-6
CrossRef Полный текст | Google Scholar
Каплан, Д.Т., Томасон И. Дж., Ван Ганди С. Д. (1979). Гистологическое исследование совместимого и несовместимого взаимодействия соевых бобов и Meloidogyne incognita . J. Nematol. 11 (4), 338–343.
PubMed Аннотация | Google Scholar
Kasukabe, Y., He, L., Nada, K., Misawa, S., Ihara, I., Tachibana, S. (2004). Сверхэкспрессия спермидинсинтазы повышает устойчивость к множественным стрессам окружающей среды и регулирует экспрессию различных регулируемых стрессом генов в трансгенном Arabidopsis thaliana . Physiol растительных клеток. 45 (6), 712–722. doi: 10.1093 / pcp / pch083
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кеннеди, Б. С., Нильсен, М. Т., Северсон, Р. Ф., Сиссон, В. А., Стивенсон, М. К., Джексон, Д. М. (1992). Химические вещества на поверхности листа из Nicotiana , влияющие на прорастание спорангиев Peronospora tabacina (adam). J. Chem. Ecol. 18 (9), 1467–1479. doi: 10.1007 / BF00993221
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Khallouk, S., Вуазен, Р., Ван Гелдер, К., Энглер, Г., Амири, С., Эсменжо, Д. (2011). Гистологические механизмы устойчивости, обеспечиваемой геном Ma против Meloidogyne incognita у Prunus spp. Фитопатология 101 (8), 945–951. doi: 10.1094 / PHYTO-01-11-0004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ким, Ю., Ким, К., Риггс, Р. (2010). Дифференциальные субклеточные ответы у устойчивых соевых бобов, инфицированных расами нематод соевых цист. Plant Pathol. J. 26 (2), 154–158. doi: 10.5423 / PPJ.2010.26.2.154
CrossRef Полный текст | Google Scholar
Ким, Ю., Ким, К., Риггс, Р. (2012). Начальные субклеточные ответы восприимчивых и устойчивых соевых бобов, инфицированных нематодой соевых цист. Plant Pathol. J. 28 (4), 401–408. doi: 10.5423 / PPJ.OA.04.2012.0054
CrossRef Полный текст | Google Scholar
Ким, Ю. Х., Риггс, Р. Д., Ким, К. С. (1987). Структурные изменения, связанные с устойчивостью сои к Heterodera glycines . J. Nematol. 19 (2), 177–187.
PubMed Аннотация | Google Scholar
Кирхштайгер, К., Феррандес, Дж., Паскуаль, М. Б., Гонсалес, М., Сехудо, Ф. Дж. (2012). НАДФН-тиоредоксинредуктаза С локализуется в пластидах фотосинтетических и нефотосинтетических тканей и участвует в формировании боковых корней у Arabidopsis . Растительная клетка 24 (4), 1534–1548. doi: 10.1105 / tpc.111.0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Knypl, J.С., Чилинска, К. М., Бжески, М. В. (1975). Повышенный уровень хлорогеновой кислоты и ингибиторов оксидазы индоил-3-уксусной кислоты в корнях моркови, зараженных северной нематодой корневого узла. Physiol. Завод Патол. 6 (1), 51–64. doi: 10.1016 / 0048-4059 (75) -6
CrossRef Полный текст | Google Scholar
Kouassi, A., Kerlan, M., Sobczak, M., Dantec, J., Rouaux, C., Ellisseche, D., et al. (2004). Устойчивость к узловатой нематоде Meloidogyne fallax в Solanum sparsipilum : анализ механизмов. Нематология 6, 389–400. doi: 10.1163 / 1568541042360519
CrossRef Полный текст | Google Scholar
Kud, J., Wang, W., Gross, R., Fan, Y., Huang, L., Yuan, Y., et al. (2019). Эффектор картофельной цисты нематоды RHA1B представляет собой убиквитинлигазу и использует два различных механизма для подавления иммунной передачи сигналов растений. PLoS Pathog. 15 (4), e1007720. doi: 10.1371 / journal.ppat.1007720
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кумар, М., Брар, А., Ядав, М., Чаваде, А., Вивекананд, В., Парик, Н. (2018). Хитиназы — потенциальные кандидаты на повышение устойчивости растений к грибковым патогенам. Сельское хозяйство 8 (7), 88. doi: 10.3390 / сельское хозяйство8070088
CrossRef Полный текст | Google Scholar
Ли, М. В., Хаффакер, А., Криппен, Д., Роббинс, Р. Т., Гоггин, Ф. Л. (2018). Пептиды-элиситоры растений способствуют защите растений от нематод сои. Мол. Завод Патол. 19 (4), 858–869. DOI: 10.1111 / mpp.12570
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лопес-Мартинес, Н., Колинас-Леон, М., Пенья-Вальдивия, К., Салинас-Морено, Ю., Фуэнтес-Монтьель, П., Биесага, М. и др. (2011). Изменения активности пероксидазы и метаболизма фенилпропаноидов, вызванные Nacobbus aberrans Thorne and Allen, 1944 у перца чили ( Capsicum annuum L.) CM334, устойчивого к Phytophthora capsici Leo. Почва растений 338 (1-2), 399–409.doi: 10.1007 / s11104-010-0553-5
CrossRef Полный текст | Google Scholar
Lin, B., Zhuo, K., Chen, S., Hu, L., Sun, L., Wang, X., et al. (2016). Новый эффектор нематод подавляет иммунитет растений, активируя систему поглощения активных форм кислорода хозяином. New Phytol. 209 (3), 1159–1173. doi: 10.1111 / nph.13701
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Lozano-Torres, J. L., Wilbers, R.H., Gawronski, P., Boshoven, J.C., Finkers-Tomczak, A., Cordewener, J.H., et al. (2012). Двойная устойчивость к болезням, опосредованная иммунным рецептором Cf-2 в томате, требует общей вирулентности гриба и нематоды. Proc. Natl. Акад. Sci. США 109 (25), 10119–10124. DOI: 10.1073 / pnas.1202867109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Lozano-Torres, J. L., Wilbers, R.H., Warmerdam, S., Finkers-Tomczak, A., Diaz-Granados, A., van Schaik, C.C., et al. (2014). Аллерген-подобные белки апопластного яда цистовых нематод модулируют активацию базального врожденного иммунитета растений рецепторами клеточной поверхности. PLoS Pathog. 10 (12), e1004569. doi: 10.1371 / journal.ppat.1004569
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Луис, Дж. Г., Флетчер, В. К., Эчеверри, Ф., Абад, Т., Киши, М. П., Пералес, А. (1995). Новые фитоалексины феналенонового типа из Musa acuminata (Colla AAA) grand nain. Нац. Prod. Lett. 6 (1), 23–30. doi: 10.1080 / 10575639508044083
CrossRef Полный текст | Google Scholar
Луке-Ортега, Дж. Р., Мартинес, С., Саугар, Дж. М., Искьердо, Л. Р., Абад, Т., Луис, Дж. Г. и др. (2004). Вызванные грибами метаболиты растений в качестве обогащенного источника новых лейшманицидных агентов: противогрибковые фитоалексины фенилфеналенона из бананового растения ( Musa acuminata ) нацелены на митохондрии Leishmania donovani промастигот. Антимикробный. Агенты Chemother. 48 (5), 1534–1540. doi: 10.1128 / AAC.48.5.1534-1540.2004
PubMed Реферат | CrossRef Полный текст | Google Scholar
Махаджан, Р., Сингх П., Баджадж К. (1985). Нематицидная активность некоторых фенольных соединений против Meloidogyne incognita . Rev. Nématol. 8 (2), 161–164.
Google Scholar
Маносалва, П., Манохар, М., фон Рейсс, С. Х., Чен, С., Кох, А., Каплан, Ф. и др. (2015). Консервативные сигнальные молекулы нематод вызывают защиту растений и устойчивость к патогенам. Нац. Commun. 6, 7795. doi: 10.1038 / ncomms8795
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Marhavý, P., Kurenda, A., Siddique, S., Denervaud Tendon, V., Zhou, F., Holbein, J., et al. (2019). Повреждение отдельных клеток вызывает региональные, ограничивающие нематоды этиленовые ответы в корнях. EMBO J. 38 (10), e100972. doi: 10.15252 / embj.2018100972
PubMed Аннотация | CrossRef Полный текст | Google Scholar
МакКлюр, М.А., Берд, А.Ф. (1976). Яичная скорлупа тиленхид (Nematoda): формирование яичной скорлупы в Meloidogyne javanica . Паразитология 72 (1), 29–39.doi: 10.1017 / S003118200004316X
CrossRef Полный текст | Google Scholar
Мехиас, Дж., Чыонг, Н. М., Абад, П., Фавери, Б., Квентин, М. (2019). Растительные белки и процессы, на которые нацелены эффекторы паразитических нематод. Фронт. Plant Sci. 10, 970. doi: 10.3389 / fpls.2019.00970
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мелилло, М., Леонетти, П., Леоне, А., Веронико, П., Блеве-Зачео, Т. (2011). Продукция АФК и NO в совместимых и несовместимых взаимодействиях томата- Meloidogyne incognita . евро. J. Plant Pathol. 130 (4), 489–502. doi: 10.1007 / s10658-011-9768-4
CrossRef Полный текст | Google Scholar
Melillo, M. T., Leonetti, P., Bongiovanni, M., Castagnone-Sereno, P., Bleve-Zacheo, T. (2006). Модуляция активности активных форм кислорода и накопление H 2 O 2 во время совместимых и несовместимых взаимодействий нематод томат-корень-узелок. New Phytol. 170 (3), 501–512. doi: 10.1111 / j.1469-8137.2006.01724.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Менди, Б., Wang’ombe, M. W., Radakovic, Z. S., Holbein, J., Ilyas, M., Chopra, D., et al. (2017). Киназа NILR1, подобная рецептору с богатым лейцином повтора Arabidopsis, необходима для индукции врожденного иммунитета к паразитическим нематодам. PLoS Pathog. 13 (4), e1006284. doi: 10.1371 / journal.ppat.1006284
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миккельсен, М. Д., Хансен, К. Х., Виттсток, Ю., Халкиер, Б. А. (2000). Цитохром P450 CYP79B2 из Arabidopsis катализирует превращение триптофана в индол-3-ацетальдоксим, предшественник индолглюкозинолатов и индол-3-уксусной кислоты. J. Biol. Chem. 275 (43), 33712–33717. doi: 10.1074 / jbc.M001667200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миккельсен, М. Д., Наур, П., Халкиер, Б. А. (2004). Arabidopsis , мутанты по C-S-лиазе биосинтеза глюкозинолатов устанавливают критическую роль индол-3-ацетальдоксима в гомеостазе ауксина. Plant J. 37 (5), 770–777. doi: 10.1111 / j.1365-313X.2004.02002.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миллиган, С.Б., Бодо, Дж., Ягоби, Дж., Калошян, И., Забель, П., Уильямсон, В. М. (1998). Ген устойчивости к нематодам корневого узла Mi из томата является членом семейства генов растений с лейциновой молнией, связывающим нуклеотиды и богатыми лейцином повторами. Растительная клетка 10 (8), 1307–1319. doi: 10.1105 / tpc.10.8.1307
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Милн, Д. Л., Бошофф, Д. Н., Бьюкен, П. В. У. (1965). Характер устойчивости Nicotiana repanda к узловатой нематоде, Meloidogyne javanica . S. Afr. J. Agric. Sci. 8, 557–570.
Google Scholar
Мур, Л. А., Мандон, Дж., Персейн, С., Кристеску, С. М., Мошков, И. Е., Новикова, Г. В. и др. (2013). Оксид азота в растениях: оценка современного состояния знаний. AoB Plants 5 pls052. doi: 10.1093 / aobpla / pls052
CrossRef Полный текст | Google Scholar
Naalden, D., Haegeman, A., de Almeida-Engler, J., Birhane Eshetu, F., Bauters, L., Gheysen, G. (2018). Эффектор Meloidogyne graminicola Mg16820 секретируется в апопласт и цитоплазму для подавления защитных реакций растения-хозяина. Мол. Завод Патол. 19 (11), 2416–2430. doi: 10.1111 / mpp.12719
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Neveu, C., Abad, P., Castagnone-Sereno, P. (2003). Молекулярное клонирование и характеристика протеазы катепсина L кишечника из узловатой нематоды Meloidogyne incognita . Physiol. Мол. Завод Патол. 63 (3), 159–165. doi: 10.1016 / j.pmpp.2003.10.005
CrossRef Полный текст | Google Scholar
Нивсаркар, М., Чериан, Б., Пад, Х. (2001). Альфа-тертиенил: инсектицид нового поколения растительного происхождения. Curr .Sci. 81 (6), 667–672.
Google Scholar
Нотнагель, Э.А., Макнил, М., Альберсхайм, П., Делл, А. (1983). Взаимодействие «хозяин-патоген»: XXII. Олигосахарид галактуроновой кислоты из стенок растительных клеток вырабатывает фитоалексины. Plant Physiol. 71 (4), 916–926. doi: 10.1104 / pp.71.4.916
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паал, Дж., Henselewski, H., Muth, J., Meksem, K., Menendez, C.M., Salamini, F., et al. (2004). Молекулярное клонирование гена картофеля Gro1-4 , придающего устойчивость к патотипу Ro1 корневой цистовой нематоды Globodera rostochiensis , на основе подхода кандидатских генов. Plant J. 38 (2), 285–297. doi: 10.1111 / j.1365-313X.2004.02047.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паломарес-Риус, Дж. Э., Эскобар, К., Кабрера, Дж., Вовлас, А., Кастильо, П. (2017). Анатомические изменения в тканях растений, вызванные паразитическими нематодами. Фронт. Plant Sci. 8, 1987. doi: 10.3389 / fpls.2017.01987
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Полсон, Р. Э., Вебстер, Дж. М. (1972). Ультраструктура гиперчувствительной реакции корней томата Lycopersicon esculentum L. на заражение узловатой нематодой Meloidogyne incognita . Physiol. Завод Патол. 2 (3), 227–234. doi: 10.1016 / 0048-4059 (72) -7
CrossRef Полный текст | Google Scholar
Pegard, A., Brizzard, G., Fazari, A., Soucaze, O., Abad, P., Djian-Caporalino, C. (2005). Гистологическая характеристика устойчивости к различным видам узловатых нематод, связанных с накоплением фенолов в Capsicum annuum . Фитопатология 95 (2), 158–165. doi: 10.1094 / PHYTO-95-0158
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Perry, R.Н., Третт, М. В. (1986). Ультраструктура яичной скорлупы Heterodera schachtii и H. glycines (Nematoda: Tylenchida). Rev. Nématol. 9 (4), 399–403.
Google Scholar
Plowright, R., Grayer, R., Gill, J., Rahman, M., Harborne, J. (1996). Индукция фенольных соединений в рисе после заражения стеблевой нематодой Ditylenchus angustus . Nematologica 42 (5), 564–578. doi: 10.1163 / 004625996X00063
CrossRef Полный текст | Google Scholar
Proite, K., Карнейро, Р., Фалькао, Р., Гомеш, А., Лил-Бертиоли, С., Гимарайнш, П. и др. (2008). Постинфекционное развитие и гистопатология Meloidogyne arenaria race 1 на Arachis spp. Plant Pathol. 57, 974–980. doi: 10.1111 / j.1365-3059.2008.01861.x
CrossRef Полный текст | Google Scholar
Qiu, J., Hallmann, J., Kokalis-Burelle, N., Weaver, D. B., Rodríguez-Kábana, R., Tuzun, S. (1997). Активность и дифференциальная индукция изоферментов хитиназы в сортах сои, устойчивых или чувствительных к нематодам корневых узлов. J. Nematol. 29 (4), 523–530.
PubMed Аннотация | Google Scholar
Райс, С. Л., Стоун, А. Р., Ледбитер, Б. С. С. (1987). Изменения клеточной структуры корней резистентного картофеля, паразитирующего цистными нематодами картофеля. 2. Картофель с устойчивостью, полученный из Solanum vernei . Physiol. Мол. Завод Патол. 31 (1), 1–14. doi: 10.1016 / 0885-5765 (87)
-6
CrossRef Полный текст | Google Scholar
Робертсон, Л., Робертсон, В.M., Sobczak, M., Helder, J., Tetaud, E., Ariyanayagam, M. R., et al. (2000). Клонирование, экспрессия и функциональная характеристика пероксиредоксина из картофельной цистовой нематоды Globodera rostochiensis . Мол. Biochem. Паразитол. 111 (1), 41–49. doi: 10.1016 / S0166-6851 (00) 00295-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Руни, Х. К., Ван’т Клостер, Дж. У., ван дер Хорн, Р. А., Йостен, М. Х., Джонс, Дж. Д., де Вит, П. Дж. (2005). Cladosporium Avr2 ингибирует протеазу Rcr3 томата, необходимую для Cf-2 -зависимой устойчивости к болезням. Наука 308 (5729), 1783–1786. DOI: 10.1126 / science.1111404
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Sacco, M. A., Koropacka, K., Grenier, E., Jaubert, M. J., Blanchard, A., Goverse, A., et al. (2009). Белок SPRYSEC RBP-1 цистовой нематоды вызывает Gpa2- и RanGAP2-зависимую гибель растительных клеток. PLoS Pathog. 5 (8), e1000564. doi: 10.1371 / journal.ppat.1000564
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Scheler, C., Дурнер, Дж., Астье, Дж. (2013). Оксид азота и активные формы кислорода в биотических взаимодействиях растений. Curr. Opin. Plant Biol. 16 (4), 534–539. doi: 10.1016 / j.pbi.2013.06.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Seo, S., Gomi, K., Kaku, H., Abe, H., Seto, H., Nakatsu, S., et al. (2012). Идентификация природных дитерпенов, ингибирующих бактериальное увядание табака, томатов и арабидопсиса. Physiol растительных клеток. 53 (8), 1432–1444.DOI: 10.1093 / pcp / pcs085
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Seo, Y., Park, J., Kim, Y., Park, Y., Kim, Y. (2014). Скрининг и гистопатологическая характеристика линий корейской моркови на устойчивость к узловатой нематоде Meloidogyne incognita . Plant Pathol. J. 30 (1), 75–81. doi: 10.5423 / PPJ.OA.08.2013.0082
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шах, С. Дж., Анджам, М. С., Менди, Б., Анвер, М.А., Хабаш, С.С., Лозано-Торрес, Дж. Л. и др. (2017). Ответные реакции хозяина, связанные с повреждением, способствуют защите от нематод кисты, но не нематод, вызывающих корневой узел. J. Exp. Бот. 68 (21-22), 5949–5960. doi: 10.1093 / jxb / erx374
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Shi, Q., Mao, Z., Zhang, X., Wang, Y., Ling, J., Lin, R., et al. (2018). Эффектор Meloidogyne incognita MiISE5 подавляет запрограммированную гибель клеток, способствуя паразитизму в растении-хозяине. Sci. Rep. 8 (1), 7256. doi: 10.1038 / s41598-018-24999-4
PubMed Реферат | CrossRef Полный текст | Google Scholar
Siddique, S., Matera, C., Radakovic, Z. S., Hasan, M. S., Gutbrod, P., Rozanska, E., et al. (2014). Паразитические черви стимулируют НАДФН-оксидазы хозяина для производства активных форм кислорода, которые ограничивают гибель растительных клеток и способствуют инфицированию. Sci. Сигнал 7 (320), ra33. doi: 10.1126 / scisignal.2004777
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смант, Г., Хелдер Дж., Говерс А. (2018). Параллельные адаптации и общие ответы клеток-хозяев, позволяющие кормить облигатных и факультативных паразитических нематод растений. Plant J. 93 (4), 686–702. doi: 10.1111 / tpj.13811
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Sobczak, M., Avrova, A., Jupowicz, J., Phillips, M. S., Ernst, K., Kumar, A. (2005). Характеристика чувствительности и резистентности к инфекции линий томатов картофельной цистной нематодой ( Globodera spp.) В отсутствие и в присутствии гена устойчивости к нематодам широкого спектра Hero . Мол. Взаимодействие с растительными микробами. 18 (2), 158–168. doi: 10.1094 / MPMI-18-0158
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Takasugi, M., Yachida, Y., Anetai, M., Masamune, T., Kegasawa, K. (1975). Идентификация спаржевой кислоты как нематицида, естественным образом встречающегося в корнях спаржи. Chem. Lett. 1, 43–44. doi: 10.1246 / cl.1975.43
CrossRef Полный текст | Google Scholar
Tameling, W. I., Baulcombe, D. C. (2007).Физическая ассоциация белка Rx устойчивости к NB-LRR с белком, активирующим ГТФазу Ran, необходима для экстремальной устойчивости к вирусу картофеля X . Растительная клетка 19 (5), 1682–1694. doi: 10.1105 / tpc.107.050880
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тейшейра, М. А., Вей, Л., Калошян, И. (2016). Узловатые нематоды индуцируют иммунитет по шаблону в корнях Arabidopsis thaliana . New Phytol. 211 (1), 276–287.DOI: 10.1111 / nph.13893
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Томасон И. Дж., Рич Дж. Р., О’Мелиа Ф. К. (1976). Патология и гистопатология Pratylenchus scribneri , поражающего фасоль и фасоль. J. Nematol. 8 (4), 347–352.
PubMed Аннотация | Google Scholar
Торрес, М. А., Дангл, Дж. Л. (2005). Функции оксидазы респираторного взрыва в биотических взаимодействиях, абиотическом стрессе и развитии. Curr.Opin. Plant Biol. 8 (4), 397–403. doi: 10.1016 / j.pbi.2005.05.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Tsai, A. Y., Higaki, T., Nguyen, C. N., Perfus-Barbeoch, L., Favery, B., Sawa, S. (2019). Регулирование поведения корневых нематод с помощью аттрактантов, полученных из слизи семенной оболочки. Мол. Завод 12 (1), 99–112. doi: 10.1016 / j.molp.2018.11.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Урвин, П. Э., Лилли, К.Дж., Макферсон, М. Дж., Аткинсон, Х. Дж. (1997). Характеристика двух кДНК, кодирующих цистеиновые протеиназы нематоды цисты сои Heterodera glycines . Паразитология 114 (6), 605–613. doi: 10.1017 / S0031182097008858
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Урвин П. Э., Левсли А., Майкл Дж., Макферсон М. Дж., Аткинсон Х. Дж. (2000). Трансгенная устойчивость к нематоде Rotylenchulus reniformis , придаваемая растениям Arabidopsis thaliana , экспрессирующим ингибиторы протеиназ. Мол. Порода 6 (3), 257–264. doi: 10.1023 / A: 1009669325944
CrossRef Полный текст | Google Scholar
Урвин П. Э., Грин Дж., Аткинсон Х. Дж. (2003). Экспрессия цистатина растения придает частичную устойчивость к Globodera , полная устойчивость достигается пирамидированием цистатина с естественной устойчивостью. Мол. Порода 12 (3), 263–269. doi: 10.1023 / A: 1026352620308
CrossRef Полный текст | Google Scholar
van der Vossen, E. A., ван дер Воорт, Дж. Н., Каньюка, К., Бендаман, А., Сандбринк, Х., Баулкомб, Д. К. и др. (2000). Гомологи одного кластера генов устойчивости картофеля придают устойчивость к различным патогенам: вирусу и нематоде. Plant J. 23 (5), 567–576. doi: 10.1046 / j.1365-313x.2000.00814.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Waetzig, G., Sobczak, M., Grundler, F. (1999). Локализация перекиси водорода во время защитной реакции Arabidopsis thaliana против нематоды, паразитирующей на растениях, Heterodera glycines . Нематология 1, 681–686. doi: 10.1163 / 156854199508702
CrossRef Полный текст | Google Scholar
Wang, K.-H., Hooks, C.R., Ploeg, A. (2007). «Защита сельскохозяйственных культур от нематод-вредителей: использование календулы в качестве альтернативы химическим нематицидам» в «Болезни растений»; PD-35 (Гонолулу: Гавайский университет).
Google Scholar
Вармердам, С., Стеркен, М. Г., ван Шайк, К., Оортвейн, М. Э. П., Сукарта, О. К. А., Лозано-Торрес, Дж. Л. и др.(2018). Полногеномное ассоциативное картирование архитектуры восприимчивости к узловатой нематоде Meloidogyne incognita в Arabidopsis thaliana . New Phytol. 218 (2), 724–737. doi: 10.1111 / nph.15034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wuyts, N., Lognay, G., Swennen, R., De Waele, D. (2006a). Инфекция и размножение нематод у трансгенного и мутантного Arabidopsis и табака с измененным метаболизмом фенилпропаноидов. J. Exp. Бот. 57 (11), 2825–2835. doi: 10.1093 / jxb / erl044
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wuyts, N., Swennen, R., De Waele, D. (2006b). Влияние продуктов фенилпропаноидного пути растений и отдельных терпеноидов и алкалоидов на поведение нематод, паразитирующих на растениях, Radopholus similis , Pratylenchus Penetrans и Meloidogyne incognita . Нематология 8, 89–101. doi: 10.1163 / 156854106776179953
CrossRef Полный текст | Google Scholar
Wyss, U., Грундлер, Ф. М. У., Мунк, А. (1992). Паразитическое поведение молоди второго возраста Meloidogyne incognita в корнях Arabidopsis thaliana . Nematologica 38, 98–111. doi: 10.1163 / 187529292X00081
CrossRef Полный текст | Google Scholar
Ян, Г. П., Байду, Р. (2018). Текущее состояние исследований устойчивости Heterodera glycines и ее влияние на селекцию сои. Инженерное дело 4 (4), 534–541. DOI: 10.1016 / j.eng.2018.07.009
CrossRef Полный текст | Google Scholar
Yang, S., Dai, Y., Chen, Y., Yang, J., Yang, D., Liu, Q., et al. (2019). Новый G16B09-подобный эффектор из Heterodera avenae подавляет защитные силы растений и способствует паразитизму. Фронт. Plant Sci. 10, 66. doi: 10.3389 / fpls.2019.00066
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ye, D. Y., Qi, Y. H., Cao, S. F., Wei, B.Q., Zhang, H. S. (2017). Гистопатология в сочетании с анализом транскриптомов выявляет механизм устойчивости к Meloidogyne incognita у Cucumis metuliferus . J. Plant Physiol. 212, 115–124. doi: 10.1016 / j.jplph.2017.02.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Yu, Q., Tsao, R., Chiba, M., Potter, J. (2005). Избирательная нематицидная активность аллилизотиоцианата. J. Food Agr. Environ. 3 (2), 218–221.
Google Scholar
Засада И. А., Феррис Х. (2003). Чувствительность Meloidogyne javanica и Tylenchulus semipenetrans к изотиоцианатам в лабораторных исследованиях. Фитопатология 93 (6), 747–750. doi: 10.1094 / PHYTO.2003.93.6.747
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан, Ю., Фостер, Дж. М., Нельсон, Л. С., Ма, Д., Карлоу, К. К. (2005). Гены хитинсинтазы chs-1 и chs-2 необходимы для развития C. elegans и ответственны за отложение хитина в яичной скорлупе и глотке, соответственно. Dev. Биол. 285 (2), 330–339. DOI: 10.1016 / j.ydbio.2005.06.037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhou, J., Jia, F., Shao, S., Zhang, H., Li, G., Xia, X., et al. (2015). Вовлечение оксида азота в зависимую от жасмоната базальную защиту против узловатой нематоды у растений томата. Фронт. Plant Sci. 6, 193. doi: 10.3389 / fpls.2015.00193
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhou, J., Xu, X. C., Cao, J. J., Yin, L. L., Xia, X.J., Shi, K., et al.(2018). Фактор теплового шока HsfA1a необходим для устойчивости нематод, опосредованной геном R , и запускает продукцию H 2 O 2 . Plant Physiol. 176 (3), 2456–2471. doi: 10.1104 / pp.17.01281
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhuo, K., Chen, J., Lin, B., Wang, J., Sun, F., Hu, L., et al. (2017). Новый эффектор MeTCTP Meloidogyne enterolobii способствует паразитизму путем подавления запрограммированной гибели клеток в растениях-хозяевах. Мол. Завод Патол. 18 (1), 45–54. doi: 10.1111 / mpp.12374
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Как нематоды помогают растениям и почвам?
Newswise — 17 мая 2021 г. — Нематоды обычно имеют плохую репутацию. Да, некоторые из этих крохотных существ могут причинить вред растениям и животным. Но мало что известно о нематодах, не являющихся паразитами, которые играют важную роль. Эшли Шоу из Университета Орегона исследует эту тему в блоге Soils Matter :
В это может быть трудно поверить, но вы, возможно, никогда не видели самого многочисленного животного на Земле: почвенных нематод! По численности они составляют восемьдесят процентов всего животного мира и обитают почти в каждой среде обитания.Это трудолюбивые и важные организмы.
Почвенные нематоды, которых я исследую, крошечные — обычно от 1/500 -го до 1/20 -го дюйма! (Но внутри кашалотов живет нематода длиной почти тридцать футов.)
Действительно, некоторые из самых известных нематод — паразиты. Существуют разные нематоды-паразиты растений и животных. Это означает, что они живут внутри или на растении или животном, не могут выжить без них и иногда убивают своего хозяина (а затем уходят).Но гораздо больше нематод живут свободно. В почве нематоды живут в водных пленках, окружающих частицы почвы. Как паразитирующие на корнях растений, так и свободноживущие нематоды играют важную роль в здоровье растений и их обратной связи с почвенным углеродом.
Невероятное разнообразие почвенных нематод существует на всех уровнях почвенной пищевой сети. В основе пищевой
сети одни питаются растениями и водорослями, другие пасутся микробами (бактериями и грибами). На более высоких уровнях пищевой сети нематоды, являющиеся хищниками и всеядными, поедают других беспозвоночных, протистов и даже других нематод.В некоторых случаях «хищные» нематоды являются «хорошими парнями», контролирующими популяции паразитических нематод.
Эта пищевая сеть важна для здоровья растений и хранения углерода в почве. Например, питаясь бактериями и грибами, нематоды, питающиеся микробами, помогают возвращать азот в почву через свои отходы. Это делает азот снова доступным для использования растениями, улучшая их рост.
Нематоды приносят и другие виды в пищевую сеть почвы. Некоторые бактерии выживают в кишечнике нематод и откладываются вместе с продуктами жизнедеятельности нематод.Еще больше подвоха на внешней стороне тел нематод. По мере того как нематоды перемещаются в почве, они откладывают бактерии в новых местах, распространяя их по всему миру. Бактерии могут способствовать и ускорять процесс разложения, возвращая углерод в почву для хранения.
Но у большинства хороших вещей есть предел: при очень больших популяциях нематоды, питающиеся бактериями и грибами, могут сокращать свои популяции. Это может привести к снижению скорости разложения и оборота питательных веществ бактериями и грибами, даже замедляя рост растений.
Нематоды, паразитирующие на растениях, атакуют корни, проникая в рот. Этот «стилет» прокалывает растительные клетки, чтобы он мог высасывать богатые углеродом соки. Некоторые нематоды выделяют химические вещества, которые вызывают поражения или опухолевидные образования на корнях. Они истощают силы растения над и под землей.
В небольших популяциях нематоды, паразитирующие на растениях, могут стимулировать рост корней, но в больших количествах они разрушают корни, останавливают рост над землей и вызывают болезни. Более низкий рост растений (как корней, так и побегов) приводит к меньшему возврату органического материала в почву и, в конечном итоге, к снижению содержания углерода в почве.
В то время как виды нематод, ответственные за болезни растений, получили много внимания, гораздо меньше известно о непаразитической части сообщества почвенных нематод, которая играет в основном полезную роль в почве. Обеспечение баланса между полезными и паразитирующими на растениях группами нематод важно для здоровья растений и их вклада в почвенный углерод.
Обычно нематоды, паразитирующие на корнях растений, вредят росту растений, а нематоды, питающиеся микробами, улучшают его, но другие нематоды также важны.Например, хищные нематоды играют важную роль в регулировании популяций нематод, паразитирующих на растениях, и нематод, питающихся микробами. Путем своего питания они контролируют популяции паразитов растений и питающихся микробами нематод, оптимизируя рост растений.
Однако хищные нематоды также очень чувствительны к изменениям окружающей среды. Их популяция часто сокращается из-за нарушений почвы, таких как использование пестицидов, удобрение, вспашка или уплотнение почвы. Ситуации, когда почва тщательно обрабатывается, часто приводит к очень низкой популяции хищников и более высокой популяции вредных групп.Хищники также чувствительны к изменениям дождя и температуры, что также может вызвать дисбаланс по отношению к вредным группам.
Мое текущее исследование посвящено изучению того, как активные методы землепользования могут помочь увеличить количество полезных групп нематод в почве за счет улучшения среды обитания почвы. Мы изучаем добавки компоста к пастбищам и можем ли они улучшить хранение углерода в почве и рост растений.
Компост напрямую обеспечивает питательными веществами и увеличивает удержание влаги в почве, улучшая рост растений.Компост также изменяет пищевую сеть почвы способами, которых не наблюдалось в некоторых других обработках на наших исследуемых участках. Мы считаем, что органическое вещество почвы в компосте улучшает среду обитания в почве для хищников, поддерживая длинные и сложные почвенные пищевые сети с многочисленными хищными нематодами, которые помогают контролировать популяции корневых паразитических нематод. В результате количество заболеваний растений и корневого паразитизма снизилось, что привело к увеличению роста растений и увеличению количества углерода в корнях при обработке компоста, что способствует накоплению углерода в почве.
Для получения дополнительной информации о почвах следите за SSSA в Facebook по адресу https://www.facebook.com/SSSA.soils, в Twitter по адресу SSSA_Soils. SSSA размещает информацию о почвах на сайте www.soils.org/discover-soils, для учителей — на www.soils4teachers.org, а для учащихся 12-го класса -го — на www.soils4kids.org.
Американское почвенное общество (SSSA) — это прогрессивное международное научное сообщество, которое способствует передаче знаний и практики для сохранения почв во всем мире.SSSA, основанная в 1936 году в Мэдисоне, штат Висконсин, является профессиональным домом для более 6000 членов и более 1000 сертифицированных специалистов, посвятивших себя развитию области почвоведения. Общество предоставляет информацию о почвах в отношении растениеводства, качества окружающей среды, устойчивости экосистемы, биоремедиации, управления отходами, вторичной переработки и разумного землепользования.
Борьба с корневыми нематодами в домашнем огороде
Нематоды — особенно нематоды корневых узлов — вызывают большие потери овощных культур на коммерческих фермах, теплицах и приусадебных участках в Северной Каролине.Узловатые нематоды — это микроскопические круглые черви, которые могут прокалывать корни некоторых видов растений и откладывать яйца внутри корней. Это придает корням «узловатый» вид (Рисунок 1 и Рисунок 2) и приводит к увяданию или низкорослости всего растения. Meloidogyne incognito , южная нематода корневого узла, наиболее распространена в Северной Каролине, но недавно были обнаружены и другие виды. Эти вредители встречаются примерно на двух третях полей, используемых для выращивания сельскохозяйственных культур в штате.
Хотя многие овощи, высаживаемые весной, такие как свекла, морковь, английский горох, салат, картофель, редис и другие, восприимчивы к нематодам корневых узлов, их можно выращивать в зараженной почве и они получают лишь незначительные повреждения, поскольку нематоды неактивны при низкой активности. температура почвы (60 ° F).Однако эти же овощи могут серьезно пострадать при посадке поздней весной, летом или осенью, когда температура почвы более подходит для активности нематод (70–85 ° F). Другие распространенные садовые овощи, выращиваемые в середине и конце лета, такие как помидоры, перец, огурцы, кабачки, баклажаны и окра, также очень восприимчивы к нематодам, вызывающим узловатость корня.
Растения, произрастающие на почвах, зараженных нематодами, обычно бывают нерасторопными, низкорослыми, желтоватыми, с желчными и загнившими корнями. Растения с инфицированными корнями более восприимчивы к другим заболеваниям, вызываемым грибами и бактериями, и, как правило, рано прекращают плодоносить.Проблемы с корневыми нематодами можно обнаружить, исследуя корни овощей на наличие заметных корневых галлов (вздутия) сразу после сбора урожая или путем анализа почвы. Потери урожая из-за этих нематод могут быть значительно уменьшены с помощью имеющихся методов борьбы. Однако перед посадкой или посевом необходимо предпринять меры по контролю. Как только нематоды попадают в корни, эффективных методов лечения не существует. В этой публикации описываются способы минимизировать проблемы с нематодами, применяя от одной до нескольких мер контроля.Наиболее надежный контроль нематод с корневыми узелками может быть достигнут путем объединения двух или более тактик, описанных в данном документе. Сочетание эффективной схемы севооборота, устойчивых сортов и избранных методов культивирования дает отличный контроль с небольшими дополнительными затратами.
Рис. 1. «Узловатые» корни растения томата, вызванные узловатой нематодой.
Рис. 2. Крупный план «узловатых» корней растения томата, инфицированного узловатой нематодой.
Севооборот — один из старейших и наиболее экономичных методов борьбы с нематодами.Ротация — это просто практика недопущения выращивания восприимчивого хозяина на одном и том же участке в течение более одного года. Как правило, посадка очень восприимчивой культуры в нескольких футах от того места, где она была выращена в прошлом году, позволит избежать повреждения нематодами. Кроме того, при наличии свободного места весь садовый участок можно переместить на новое место через год или два. Когда садовый участок переносится, полезно выбрать участок, который был засажен травой в течение нескольких лет. К растениям-не растениям-хозяевам, которые особенно подходят для севооборота с овощами, относятся овсяница, мелкие зерна и бархатцы.
Домашним садоводам стоит серьезно подумать о сукцессионных посадках (многократных посевах) по вахтовой схеме. Например, если на одном участке сада выращивают краткосрочный овощ, восприимчивый к завязыванию корня, осенний урожай (такой как устойчивый сорт томата) часто можно выращивать на той же почве без потери урожая. Часто проще спланировать программу севооборота, разделив огород на три части. При такой схеме легче учитывать все факторы, влияющие на рост растений, такие как тень, удобрения, вода и время сбора урожая.
Некоторые сорта овощей устойчивы к узловатым нематодам и дают хороший урожай даже в присутствии нематод. Эффективность повышается в сочетании с севооборотом. Путем чередования устойчивых к завязкам и восприимчивых овощей в определенной части сада из года в год можно уменьшить общую проблему нематод, предотвращая накопление больших популяций.Такая практика снизит риск серьезного повреждения чувствительных овощей. В таблице 1 перечислены сорта овощей, обладающие устойчивостью к наиболее распространенной и распространенной нематоде корневых узлов. Многие из этих сортов, особенно помидоры, можно купить в местных центрах по уходу за газонами и садами или через интернет-магазины. Другие труднее получить, и их, возможно, придется заказывать непосредственно у производителя.
Если невозможно переместить весь садовый участок, следует рассмотреть возможность использования устойчивых и восприимчивых сортов овощей.Например, можно вырастить устойчивый к корневым узлам сорт томатов на данном участке в течение одного года, а в следующем году — выращивать фасоль, без значительного снижения урожайности. Пока один и тот же овощ не выращивается из года в год на одном и том же участке, потери урожая должны быть сведены к минимуму.
| Урожай | Разновидность | ||
| Фасоль, масло (Лима) | Немагрин | ||
| фасоль, оснастка | Изобилие | Претендент | Кентукки Чудо |
| Комбайн | |||
| Pea, английский | Вандо | ||
| Горох южный (Cowpea) | California Blackeye No.5 | Геркулес | Техасский крем |
| Колосс | Магнолия Блэкай | Уортмор | |
| Клемсон Пурпурный | Миссисипи Серебро | Кремовая застежка-молния | |
| ДиксиЛи | Миссисипи Фиолетовый | ||
| Перец колокольчик | Чарльстон Белль | Каролина Уандер | |
| Перец острый | Каролина Кайенна | Миссисипи Немахарт | Чарльстон Хот |
| Сладкий картофель | Самоцвет | Красный самоцвет | |
| Помидор, вишня или виноград | Аперо F1 | Нова F1 | Сладкий миллион F1 |
| BHN-968 | Малышка | ||
| Фаворита F1 | Свит Челси F1 | ||
| Помидор, Слива | Гранадеро | Пони Экспресс F1 | Виндо Бокс Рома F1 |
| Мариана F1 | Снома | ||
| Мюриэль | Тачи | ||
| Помидор круглый | Амелия VR F1 | Девица F1 | Раннее испытание Парка |
| Аплодисменты F1 | ДРТ-04-132 F1 | Воппер Парка | |
| Эпплгейт F1 | Эль Сид F1 | Пегасо F1 | |
| Армандо F1 | Империя | Розовая девочка F1 | |
| Биф Мастер F1 | Флетчер | Ред Баунти F1 | |
| Лучше Бой F1 | Голиаф F1 | Красный виноград F1 | |
| BHN-543 | Гранадеро F1 | Красная голова F1 | |
| BHN-585 | Выбор бабушки F1 | Сакура F1 | |
| BHN-1021 | Имперский 643 | Самурай F1 | |
| Биг Биф F1 | Итальянский Голиаф | Солнечный Голиаф | |
| Bobcat | Устройство Jetsetter F1 | Супер втулка | |
| Ранняя девочка Буша | Лимонный мальчик F1 | Супер фантастика | |
| Буш Голиаф | Максифорт F1 | Супер Марцано F1 | |
| Знаменитость F1 | Монтичелло | Крутой мальчик F1 | |
| Верховный знаменитости F1 | Маунтин Фреш Плюс F1 | Ультра Бой II | |
| Чемпион II F1 | Mountain Merit | Ультра Девушка | |
| Корона PS | г.Некрасивый | Вероника | |
| Криста F1 | Памелла F1 | Виктория Верховный | |
Методы культивирования могут минимизировать повреждение нематодами корневых узлов. Такие методы, как удаление корней каждой культуры сразу после сбора урожая с последующей обработкой почвы два-три раза, очень эффективны для снижения уровня нематод.Также полезно два-три раза осенью обработать весь сад и посадить озимые покровные культуры однолетней ржи, ржи или пшеницы. Обработка почвы уничтожит корни растений и предотвратит дальнейшее размножение нематод. Это также подвергнет нематод сушке под действием солнца и ветра, что уменьшит популяцию нематод. Поддержание оптимальных условий для роста растений с точки зрения pH почвы, плодородия и влажности почвы повысит устойчивость к низкому и умеренному давлению нематод, а также сделает растения менее восприимчивыми к другим стрессам.
Частое внесение в почву органических веществ, особенно больших доз (от 400 до 500 фунтов на 100 квадратных футов) компостированных листьев, скошенной травы и навоза, также способствует улучшению структуры почвы и удержанию влаги. Это также будет способствовать биологическому контролю над нематодами. Использование таких органических материалов может потребовать дополнительного азота.
Другие способы борьбы с нематодами, включая использование растений, свободных от нематод, или почвы и солнечное нагревание под пластиком, являются недорогими и простыми методами борьбы с нематодами.Чтобы убить нематод в почве, нагрейте небольшое количество влажной почвы до 140 ° F в духовке или с помощью соляризации. Нагревания почвы в духовке в течение периода времени, необходимого для запекания картофеля среднего размера, помещенного в центр почвы, достаточно для уничтожения нематод; однако это практично только для небольшого количества почвы. Соляризация заключается в том, чтобы плотно накрыть почву прозрачным пластиковым покрытием и оставить на солнце от трех до пяти дней. Этот метод будет лучше всего работать в середине лета, и почву следует подвергать воздействию прямых солнечных лучей в таких местах, как подъездная дорожка или тротуар.Почву, свободную от нематод, можно приобрести в садовых магазинах.
Нематоды вызывают обширные травмы многих овощей в более чем половине садов в Северной Каролине. Меры по борьбе с нематодами позволят значительно уменьшить количество корневых узлов и других нематод на садовом участке. Продолжение комбинированного использования ротации, устойчивости и культивирования минимизирует повреждение нематод и со временем снизит численность нематод до низкого уровня популяции, так что серьезная проблема вряд ли возникнет.Проблемы с корневыми нематодами можно обнаружить, исследуя корни овощей вскоре после завершения сбора урожая или путем анализа образца почвы. Пораженные корневыми узелками дыня, огурец, баклажан, окра, тыква, томат и другие восприимчивые культуры будут иметь очень заметные корневые галлы (вздутие).
- Инга Медоуз
- Старший научный сотрудник, Патология овощных и травяных декоративных растений
Энтомология и патология растений
- Шарль Аверре
- Почетный профессор
Энтомология и патология растений
Дополнительную информацию можно найти на следующих веб-сайтах NC State Extension:
Дата публикации: фев.15 августа 2018 г.
AG-420
Рекомендации по использованию сельскохозяйственных химикатов включены в эту публикацию для удобства читателя. Использование торговых марок и любое упоминание или перечисление коммерческих продуктов или услуг в этой публикации не означает одобрения со стороны государственного университета штата Северная Каролина или государственного университета Северной Каролины и штата Калифорния, а также дискриминации в отношении аналогичных продуктов или услуг, не упомянутых.Лица, использующие сельскохозяйственные химикаты, несут ответственность за то, чтобы их предполагаемое использование соответствовало действующим нормам и этикетке продукта. Обязательно получите актуальную информацию о правилах использования и изучите текущую этикетку продукта перед нанесением любого химического вещества. За помощью обращайтесь в местный окружной центр NC Cooperative Extension.
N.C. Cooperative Extension запрещает дискриминацию и домогательства независимо от возраста, цвета кожи, инвалидности, семейного и семейного положения, гендерной идентичности, национального происхождения, политических убеждений, расы, религии, пола (включая беременность), сексуальной ориентации и статуса ветерана.
Важность нематод, паразитирующих на растениях, в сельскохозяйственных культурах Колорадо — 2,952
Распечатать этот информационный бюллетень
Рамеш Покхарел * (3/13)
Краткая информация…
- Нематоды — это почти микроскопические животные в форме червей, многие из которых практически невидимы невооруженным глазом, когда они находятся в почве или в растительном материале.
- Многие нематоды питаются бактериями и грибами в почве и, в свою очередь, становятся их жертвами.
- Выживание, рост и размножение нематод во многом зависят от влажности почвы, температуры почвы и / или тканей хозяина, а также наличия источника пищи или подходящего растения-хозяина.
- Симптомы, вызываемые большинством нематод, паразитирующих на растениях, трудно отличить от симптомов, вызванных другими проблемами, связанными с почвой.
Нематоды — это почти микроскопические животные в форме червей, многие из которых практически невидимы невооруженным глазом, когда они находятся в почве или в растительном материале.Из известных видов нематод приблизительно 50%, 25%, 15% и 10% являются свободноживущими, морскими паразитами, паразитами животных и нематодами, паразитирующими на растениях (PPN), соответственно. Свободноживущие нематоды очень важны для поддержания биодинамической системы почвы, особенно в почве с низким содержанием органических веществ, тогда как PPN питаются растениями и снижают рост сельскохозяйственных культур и урожайность. Свободноживущие нематоды способствуют микробной колонизации субстратов и минерализации питательных веществ, распространяя микробные размножения по всей почве.Кроме того, метаболиты нематод могут также стимулировать рост определенных бактерий, высвобождая ограничивающие рост питательные вещества, такие как азот (N) и витамины. Многие питаются бактериями и грибами в почве и, в свою очередь, становятся жертвами универсальных хищников (включая всеядных и хищных нематод). Это улучшает круговорот питательных веществ и способствует медленному высвобождению питательных веществ. Вклад свободноживущих нематод в минерализацию азота (делая азот доступным для растений) и минерализацию других питательных веществ почвы относительно высок по сравнению с бактериями в почвенных экосистемах.Эти свободноживущие нематоды также питаются другими почвенными микробами, в том числе патогенами растений (бактериями, грибами и нематодами). Свободноживущие нематоды важны для почв Колорадо для любой системы растениеводства. Другая группа, называемая энтомопатогенными нематодами (например, роды Steinernema и Heterorhabditis ), чрезвычайно смертельна для многих важных почвенных насекомых-вредителей и, тем не менее, безопасна для растений и животных; они используются для борьбы со многими насекомыми, населяющими почву.
Яйца откладывают в корни или окружающую почву самки PPN и из них вылупляются червеобразные личинки, которые обычно проходят четыре линьки, чтобы достичь зрелости.Выживание, рост и размножение нематод во многом зависят от влажности почвы, температуры почвы и / или тканей хозяина, а также наличия источника пищи или подходящего растения-хозяина, особенно для PPN. При благоприятных условиях размножение нематод будет продолжаться до тех пор, пока корм не иссякнет. Однако нематоды могут выжить в плохих почвенных условиях в виде яиц или личинок. Только несколько родов или видов PPN питаются надземными частями растений, в то время как большинство PPN питаются подземными частями растений, такими как корни, луковицы и клубни.Они питаются растительными клетками, используя структуру, похожую на копье, называемую стилетом, которая характерна для большинства PPN. Они используют эти маленькие, острые, полые структуры, чтобы всасывать сок растительных клеток путем сосания и тем самым ослаблять растение-хозяин. PPN могут быть эндопаразитическими (оставаться и питаться внутри клетки), полуэндо или полуэкто паразитическими (половина тела внутри и половина снаружи поверхности растения) и / или эктопаразитическими (оставаться и питаться извне растительной клетки).
Кроме того, повреждение этими нематодами при кормлении предрасполагает растения к травмам от зимних холода и / или весенних заморозков (особенно плодов деревьев), повреждению высокого pH почвы, дефициту питательных микроэлементов и другим болезням, вредителям и сорнякам.Все это общие проблемы в западном Колорадо. И наоборот, плохое питание сельскохозяйственных культур, плохое управление посевами, состояние здоровья почвы и инфекционные заболевания также могут предрасполагать растения к холодовым травмам и повреждениям нематодами. Распространенными видами PPN, связанными с культурами в Колорадо, являются: поражение корней ( Pratylenchus spp.), Луковицы и стебель ( Ditylenchus spp.), Листовая ( Aphelenchoides spp.), Кинжал ( Xiphinema spp.), корневой узел ( Meloidogyne spp.), ланцовый ( Hoplolaimus spp.), цитрусовых ( Tylenchulus spp.), спиральных ( Helicotylenchus spp.), кольцевых ( Criconemoides spp.) и каскадных ( Tylenchulus spp.). Большинство из них важны для выращивания одной или нескольких культур в Колорадо. Эти нематоды сами по себе или в сочетании с другими факторами снижают урожайность сельскохозяйственных культур. Кроме того, некоторые PPN, включая виды Longidorus (булавочная нематода), Trichodorus , Paratrichodorus (короткокорневая нематода) и Xiphinema (кинжальная нематода), передают вирусы растений, с которыми трудно бороться.Эти вирусы и / или нематоды ослабляют растения до такой степени, что их легче убить другими причинами, такими как болезнь, насекомые, холод или другие стрессовые факторы, характерные для условий Колорадо. Питание большой популяцией нематод корневой системой растений нарушает способность корней впитывать воду и минералы и транспортировать питательные вещества к побегам. Это ограничивает рост корней, снижает жизнеспособность растений и подавляет / замедляет рост побегов; сочетание этих факторов приводит к снижению качества урожая и / или урожайности.Считается, что в дополнение к прямому повреждению растений в результате кормления нематодами, нематоды вводят в растение вредные вещества во время кормления. Симптомы, вызываемые большинством нематод, паразитирующих на растениях, трудно отличить от симптомов, вызванных другими проблемами, связанными с почвой. Таким образом, идентификация нематод по симптоматике затруднена.
| Рис. 1. Растения в желтых пятнах сильно заражены нематодами стебля люцерны в поле. |
Что они делают с растениями (симптомы и травмы):
- неравномерный рост растений — в основном участки и плохая приживаемость растений, что приводит к нездоровому внешнему виду (рис.1)
- растений со временем ослабли и погибли в сочетании с другими проблемами
- хлороз и задержка роста (напоминающие симптомы некоторых вирусных инфекций или недостаточности питательных микроэлементов)
- узелки (галлы), поражения на корнях, короткие корни или разветвления корней — можно спутать с азотфиксирующими бактериями на корнях бобовых культур
- Чрезмерное ветвление корней и симптомы волосистых корней
- Плохое здоровье корней, рост и укоренение
Хотя с растениями связаны сотни различных видов нематод, не все они являются паразитами растений.И во многих случаях популяции PPN слишком малочисленны, чтобы вызвать серьезное повреждение растений. Нематоды из образцов почвы или инфицированных частей растений должны быть извлечены, идентифицированы и подсчитаны, чтобы определить, являются ли один или несколько видов нематод [и какой (-ые)] причиной плохого роста растений. Знание количества присутствующих PPN помогает определить стратегии контроля. Если уровень популяции достаточно высок, чтобы нанести экономический ущерб (то есть на уровне «порога экономической плотности» для этого вида или выше), то рекомендуется применять стратегии борьбы.В следующей таблице приведен общий экономический пороговый уровень для восьми различных важных нематод, обнаруженных в почве Колорадо. Однако эти числа могут нуждаться в корректировке при рассмотрении других переменных, поскольку пороговые значения плотности зависят от культуры, местоположения, типа почвы и истории посевов. Например, пороги плотности для экономического ущерба персикам в суглинках глинистых почв будут составлять> 39 кольцевых нематод,> 99 корневых нематод и> 49 кинжальных нематод на 100 миллилитров 100 (мл) почвы; это будет отличаться для других типов почвы и для других культур.
| Организм | Порог | Организм | Порог |
| Поражение корней нематода общая | 500-1000 | Спиральная нематода | 300-500 |
| Нематода для поражения корней у сухой фасоли | > 250 / корень | Стеблевая нематода люцерны | > 1000 |
| Кинжал нематода | 50-100 | Корневая нематода | 100 |
| Копье | 40–150 | Трюковая нематода | 150-300 |
| Кольцевая нематода | 250-600 | Цитрусовая нематода | 10-100 |
Важные растительные паразитические виды нематод в сельскохозяйственных культурах
Воздушные питатели:
Внекорневая кормушка ( Aphelenchoides spp.): Это одна из немногих нематод, паразитирующих на растениях, которая живет в листьях, почках и других мягких надземных частях растений и повреждает их, а не корни. Внекорневые нематоды имеют широкий круг хозяев и способны заражать сотни видов растений. Однако степень тяжести зависит от хозяина, окружающей среды и вида нематод. Сморщивание листьев, деформация и карликовость растения с соответствующим снижением цветения на различных растениях, включая клубнику и хризантему, вызывают снижение жизнеспособности растений; повреждение газонных трав также отражается снижением жизнеспособности растений.У декоративных растений наиболее характерным полевым признаком листовых нематод является наличие поражений (неокрашенные участки листвы), ограниченных основными жилками на листьях. Эта нематода в больших количествах встречается в некоторых местах на этих культурах, выращиваемых в Колорадо. Нематода проникает в растения-хозяева и покидает их через естественные отверстия, и для их передвижения на поверхности листьев должна быть свободная влага.
Кормушка для луковиц и стеблей (Ditylenchus spp.): Существуют два важных вида товарных культур: Ditylenchus dipsaci и Ditylenchus destructor.
Ditylenchus dipsaci : это одна из самых губительных нематод, паразитирующих на растениях, особенно в регионах с умеренным климатом. Известно, что он имеет более 10 биологических рас, некоторые из которых имеют ограниченный круг хозяев, в то время как другие инфицируют более 450 различных видов растений, включая множество сорняков. Основными хозяевами являются люцерна, фасоль, лук, чеснок, лук-порей, кукуруза, овес, горох, картофель, рожь, клубника, сахарная свекла, табак, берсем, клевер и тюльпан. Также сообщалось о гвоздике, сельдерее, чечевице, рапсе, петрушке, подсолнечнике и пшенице.Практически повсеместно встречается выращивание этих культур с разной степенью посадки.
| Рис. 2. Симпции белого флажка, вызванные Ditylenchus у люцерны. |
D. dipsaci — мигрирующий эндопаразит, который питается паренхиматозной тканью в стеблях и луковицах, вызывая разрушение средних пластинок клеточных стенок. Кормление часто вызывает набухание и деформацию надземных частей растения (стебли, листья, цветы), а также некроз или гниение оснований стеблей, луковиц, клубней и корневищ, которое начинается в поле и продолжается при хранении.Жизненный цикл луковых растений при температуре 59 ° F (15 ° C) занимает около 20 дней. Самки откладывают от 200 до 500 яиц каждая. Молодь четвертой стадии имеет тенденцию скапливаться на поверхности сильно зараженной ткани или чуть ниже нее, образуя скопления «шерсти угря» и способная выжить в засушливых условиях в течение нескольких лет; они также могут прикрепляться к семенам растений-хозяев (например, лука, люцерны, Trifolium pratense, бобы faba, Phlox drummondii ). В глинистых почвах D. dipsaci может сохраняться в течение многих лет.Прохладные влажные условия способствуют проникновению этой нематоды в молодые ткани растений. Растения люцерны имеют тенденцию к низкорослости с очень маленькими «ушастыми» листьями, стеблями с укороченными междоузлиями и раздутыми узлами, а также с бледно-желтыми или белыми побегами (часто называемыми белыми флажками, рис. 2). Этот симптом легко наблюдается при доращивании ранней весной или сразу после первой стрижки. Зараженные стебли ломкие и имеют тенденцию отламываться от коронки, а инфицированные коронки не твердые и могут иметь губчатую консистенцию.Зараженные участки поля зеленеют весной примерно на 2-3 недели медленнее по сравнению с незараженными участками и, по-видимому, погибают зимой. Растения погибнут, а на стендах появятся пятна. Снижение древостоя увеличивает давление сорняков на пораженных полях. Мы наблюдали высокую заболеваемость другими почвенными грибковыми патогенами, такими как Rhizoctonia , связанными с люцерной, пораженной стеблевой нематодой люцерны в песчаной почве.
Проникновение нематод в листья лука вызывает деформацию листьев и вздутие листьев или образование пузырей на поверхности; листья растут беспорядочно, часто бывают увядшими, хлоротичными; а высокое количество нематод может фактически убить более молодые растения.Внутренние чешуйки луковицы обычно более серьезно повреждены, чем внешние чешуи, луковицы размягчаются и при разрезании чешуйки появляются в виде концентрических кругов. У чеснока пожелтение и отмирание листьев происходит без деформации или вздутия листьев. Может переноситься на сухие семена и посадочный материал растений-хозяев. В полевых условиях молодь четвертой стадии может выдерживать иссушение в течение многих лет с постепенным снижением выживаемости в течение многих лет без растения-хозяина. Выживаемость нематод и их повреждение больше на тяжелых почвах по сравнению с песчаными почвами.Нематоды распространяются в новые районы через поверхностный водный сток, ирригацию, переносимые ветром остатки сельскохозяйственных культур, почву и остатки сельскохозяйственных культур, прилипшие к оборудованию, людям и скоту, а также вместе с семенами. Сток воды очень важен для распространения стеблевых нематод в пределах поля и на прилегающие поля.
Ditylenchus destructor заражает картофель и не выдерживает высыхания (в отличие от D. dipsaci ), поэтому обычно это важно только в прохладных влажных почвах. Без устойчивой стадии покоя этот вид зимует в почве взрослыми особями, личинками или, возможно, яйцами; он может даже размножаться в более теплые зимы, питаясь альтернативными хозяевами сорняков и / или грибным мицелием.Яйца вылупляются весной, и личинки сразу же способны паразитировать на хозяевах. При температуре 82 ° F (28 ° C) вылупление яиц начинается через 2 дня после кладки яиц, со средним интервалом 4,4 дня между кладкой яиц и вылуплением; Развитие от яйца до взрослой особи занимает от 6 до 7 дней. Нематода поражает только подземные, а не надземные части растений. Они проникают в клубни картофеля через чечевицы, а затем начинают быстро размножаться и поражают весь клубень. Они могут продолжать жить и развиваться в клубнях при хранении.
На надземных частях растений явных симптомов не наблюдается, хотя сильно зараженные клубни дают слабые растения, которые обычно умирают в начале сезона. Маленькие не совсем белые пятна на здоровой мякоти — характерные симптомы ранних инфекций, которые можно обнаружить, очистив клубень. Эти пятна увеличиваются, темнеют, имеют шерстистую текстуру и могут быть немного полыми в центре. Слегка запала, потрескавшаяся и морщинистая кожица может быть отделена от подлежащей мякоти сильно пораженных клубней.Мякоть сухая, от сероватого до темно-коричневого или черного цвета. Это изменение цвета во многом связано с вторичным вторжением грибов, бактерий и свободноживущих нематод. D. distructor также поражает ирис, тюльпан и арахис.
Корневые питатели:
Нематода, поражающая корни ( Pratylenchus spp.): Это наиболее распространенный род нематод, паразитирующих на растениях, наблюдаемых на сельскохозяйственных культурах Колорадо, и имеет очень широкий диапазон хозяев от пропашных культур, овощей и декоративных растений до плодов деревьев.На луковых полях это наблюдается в больших количествах, особенно в районах с больными на вид растениями или с плохой продуктивностью в анамнезе. Повреждение этой нематодой может быть серьезным на луковых полях, чередующихся с кукурузой, поскольку она поражает как кукурузу, так и лук. В фруктовых садах эта нематода может быть основной причиной неудачных попыток пересадки. Очень большое количество этой нематоды наблюдалось в Колорадо на газонной зелени с пятнами желтых растений. Это может быть серьезной проблемой для картофеля, винограда, пшеницы и кукурузы, особенно для культур, выращиваемых на легких почвах.Пораженные нематоды ( Pratylenchus neglectus и P. thornei ) в большом количестве встречаются на многих неорошаемых полях Тихоокеанского Северо-Запада, снижая урожайность на 70% у восприимчивых сортов яровой пшеницы с незначительным или отсутствующим визуальным проявлением симптомов в полевых условиях. полог урожая отличается от обычно небрежного вида. P. neglectus наблюдался на 70% обследованных пшеничных полей в Колорадо, тогда как P. vulnus является наиболее распространенной нематодой, поражающей корни плодовых культур, вызывая повреждение яблони, персика, вишни и винограда.
Большое количество нематод, поражающих корень, часто приводит к тому, что корень становится коричневым и умирает, что является обычным симптомом инфекции. Однако корни некоторых растений нечувствительны и не буреют. Помимо гибели клеток корня, вызванной непосредственно движением и питанием нематод, раны, возникшие в результате деятельности нематод, позволяют другим почвенным микроорганизмам проникать в ткани корня и способствовать гниению и разложению корней. На всех подвижных стадиях поражения корней нематода проникает в корневые и норные туннели через кору корня.Яйца, откладываемые в тканях корня или в почве, вылупляются, а вылупившаяся молодь попадает или остается в корнях и вызывает повреждение корня. Нематоды, пораженные корнями, являются мигрирующими и поэтому способны многократно входить в корневую ткань и выходить из нее, хотя внутри корней может возникнуть несколько поколений без миграции нематод в окружающую почву. Эти нематоды вызывают небольшие коричневые поражения на белых боковых корнях и убивают мелкие питающие корни. Когда эти поражения сливаются, вся корневая система кажется обесцвеченной.Сильно пораженные растения, особенно деревья, могут потерять все кормовые корни. Эта нематода представляет собой серьезную проблему на участках повторной посадки фруктовых садов, поскольку она вызывает заболевание, при котором молодые повторно пересаженные деревья плохо растут и могут погибнуть, а существующие деревья не имеют однородности. Верхняя часть зараженного дерева, если она не мертва, часто демонстрирует задержку роста, хлороз и усыхание веток со снижением жизнеспособности, особенно в персиковых и вишневых садах.
Кинжал Нематода ( Xiphinema spp.): Один из крупнейших PPN (рис.3 слева), эта нематода своим питанием наносит прямой ущерб большому количеству растений, а некоторые виды кинжалов также передают почвенные вирусы растений. Эта передача вируса особенно важна для фруктовых культур в Колорадо, поскольку в ней задействованы многие важные и распространенные фруктовые вирусы. В садах Колорадо эта нематода обычно наблюдается почти во всех типах плодовых культур, на подвоях, местах и типах почвы. Самки откладывают яйца поодиночке в почву рядом с растениями, и из них вылупляются птенцы первой стадии.Самцы наблюдаются редко. Кинжальные нематоды обычно имеют 3-4 стадии молоди, им требуется от 6 до 12 месяцев для завершения своего жизненного цикла и могут жить до 3 лет при благоприятных почвенных условиях.
| Рис. 3. Слева: взрослая кинжальная нематода ( Xiphinema sp .: обратите внимание на длинное тело) с фото-вставкой, показывающей характерный длинный стилет с базальными фланцами. Справа: листочки на нижней стороне вишневых листьев из-за заражения вирусом Cherry Rasp Leaf. |
Плотность нематод Dagger, наблюдаемая в большинстве яблоневых садов Западной Колорадо (18–152 нематод на 100 мл почвы), выше экономического порогового уровня для яблони (10–100 нематод на 100 мл почвы).Однако для других культур экономические пороговые уровни неизвестны. Эктопаразитические кинжальные нематоды не зарываются в корни, а вставляют свой длинный стилет глубоко в кончики корней, где они питаются клетками кончиков корней. Питание кинжальной нематодой вызывает некроз, задержку роста и отек кончиков корней. Над поврежденными кончиками корней могут появиться несколько боковых корней. Набухание кончиков корней можно спутать с галлами корневых нематод. Даггарские нематоды также могут нанести ущерб многим другим культурам, особенно если их популяция высока.
Известно, что одиннадцать видов кинжальных нематод являются переносчиками 13 важных фруктовых вирусов НЕПО. Вирус листьев вишневого рашпиля (CRLV) (рис. 3), важная и распространенная проблема в вишневых садах западного Колорадо, передается комплексом видов нематод X. americanum dagger. Тот же комплекс также вызывает болезнь плоского яблока у яблока, которая не так серьезна, как проблема CRLV в западном Колорадо. Другой вирус, переносимый X. rivesi и X. americanum , — это вирус кольцевой пятнистости томатов (TmRSV), вызывающий ямку на стебле Prunus (PSP).По неопубликованной информации в Колорадо обитают X. thorneii и X. utahensis . Популяции кинжальных нематод, наблюдаемые в вишневых садах западного Колорадо (15-70 нематод на 100 мл почвы), очень высоки, поскольку 1 нематоды на 100 мл почвы достаточно для передачи CRLV. Идентификация видов, обитающих в Колорадо, продолжается. Некоторые другие важные фруктовые вирусы, передающиеся кинжальной нематодой: вирус листьев виноградной лозы, вирус желтой жилки виноградной лозы, вирус пятна табачного кольца, вирус мозаики персиковой розетки и три штамма TmRSV, вызывающие мозаику из желтых бутонов персика, черносливовую коричневую линию и ямку на стеблях чернослива. .Вирусы приобретаются в течение 24 часов после начала кормления и переносятся в просвете пищевода до 12 месяцев. Частицы вируса передаются как взрослыми, так и подростками.
| Рис. 4. Взрослая особь спиральной нематоды ( Helicotylenchus sp.), Демонстрирующая характерную спиралевидную форму тела с толстым хвостом и коротким толстым стилусом. |
Спиральная нематода ( Helicotylenchus spp.): Эта часто наблюдаемая нематода часто встречается в большем количестве (по сравнению с другими нематодами) в почвах, связанных со всеми культурами, выращиваемыми в Колорадо (рис. 4). Спиральные нематоды могут создавать стресс для кукурузы, сои и других пропашных культур в жаркую и засушливую погоду, но редко вызывают потерю урожая даже при высокой численности населения. Эта нематода важна для земледелия на засушливых землях. Спиральные нематоды питаются у кончиков корней или рядом с ними, вызывая девитализацию, наиболее серьезный тип повреждения корня, и вызывают укорочение первичных и боковых корней и крупных корневых систем, лишенных питающих корней.Они могут вызывать стресс у растений, особенно когда присутствуют в большом количестве. Эта нематода редко считается важной, поскольку она не вызывает серьезных потерь урожая. Тем не менее, это может быть важно для сельскохозяйственных культур в Колорадо, поскольку их было много, и потому что в Колорадо есть много других факторов стресса. Спиральные нематоды обычно являются эктопаразитами, но некоторые из них являются полуэндопаразитами, а некоторые — эндопаразитами. Экто и полуэндопаразиты откладывают яйца в почву возле корней, а эндопаразиты откладывают яйца внутри корней.Этот род, насчитывающий 186 видов, имеет широкий спектр хозяев, включая газонные травы, самшит и другие декоративные растения, кукурузу, сою и табак; но только четыре вида связаны с подавлением роста растений.
Узловая нематода ( Meloidogyne spp.): Этот вид нематод представляет собой серьезную проблему для почти всех сельскохозяйственных культур, выращиваемых на легких почвах. В Колорадо это проблема картофеля, лука (особенно на песчаной почве), фруктовых садов и многих пропашных культур. Узловая нематода — это малоподвижный эндопаразит; личинки питаются корнями и снижают урожайность сельскохозяйственных культур.Яйца, отложенные в студенистой матрице, могут долгое время выживать в почве и вылупляться при благоприятных условиях окружающей среды. Клубневые нематоды могут перейти от яйца к воспроизводящейся взрослой особи (полный жизненный цикл) всего за 3-4 недели (рис. 5, слева).
| Рис. 5. Слева: личинки Meloidogyne (A), молодая самка (B) и зрелая самка (C), демонстрирующие форму тела. Справа: повреждение редиса (A) заражением растущих корней в начале сезона и корневые галлы томатов, вызванные узловатой нематодой (B).Фотография B предоставлена доктором Гарольдом Ларсеном. |
Личинки проникают внутрь корней и питаются ими, в то время как самцы стерильны и не причиняют вреда. Питание нематод может вызвать гибель кончика роста и вызвать ветвление (рис. 5 справа, A), и / или клетки корня вокруг самки нематоды реагируют многократным делением и увеличением с образованием галла (рис. 5 справа, B). В зависимости от конкретного вида корневых нематод, восприимчивости растения-хозяина и количества инфицирующих нематод корневые галлы могут варьироваться по размеру от 1/8 дюйма до 1 или более дюймов в диаметре.На высоких уровнях популяции большая часть корней истирается. По мере того как самка нематоды питается внутри корня, галл увеличивается и приобретает сферическую форму; Через 15-30 дней после заражения самка откладывает 200-500 яиц в массе, прикрепленной к ее телу. Корневые галлы легко увидеть, а растения, инфицированные корневыми узлами, можно легко распознать, выкорчевав растения и посмотрев на корни (рис. 5, справа). Однако корневые галлы часто легко отделяются и остаются в почве при выдергивании растений и даже под давлением воды во время мытья.Есть четыре важных вида Meloidogyne, которые нападают на многих хозяев, включая фрукты, но они более проблематичны в жарком климате, чем в прохладном.
Кольцевая нематода ( Criconemoides spp.): Обнаружено, что несколько видов Criconemoides и родственных родов поражают культурные растения, особенно плодовые. Это маленькие, сигарные, строго эктопаразитические нематоды (рис. 6), которые питаются поверхностью корня и вызывают потемнение нежных тканей.Они не имеют большого значения для большинства культур, но могут способствовать серьезному снижению или полному отказу персика и нектарина, привитых на чувствительные подвои. Criconemoides обычно встречается во многих фруктовых садах (включая персиковые) в Колорадо, особенно с песчаными или легкими почвами. Жизненный цикл занимает 25-35 дней. После кормления корнями в течение нескольких дней самки откладывают по одиночке яйца каждые два-четыре дня. Молодые особи второй стадии (J2) вылупляются из яйца через 11-15 дней, линяют до J3 за три-пять дней, линяют до J4 через четыре-семь дней и становятся взрослыми через пять-шесть дней.Самцов почти не наблюдается.
| Рис. 6. Взрослая кольцевая нематода ( Criconemoides xenoplax ). Обратите внимание на крепкую форму тела с толстыми кольцами кутикулы и толстым стилетом. (Фото доктора Гарольда Ларсена). |
Кольцевые нематоды вызывают более серьезные повреждения в крупнозернистых почвах, чем в мелкозернистых почвах. Оптимальные условия для размножения включают pH около 7 и температуру почвы 75-80 ° F (24-27 ° C).Кольцевые нематоды, по-видимому, чувствительны к низкой влажности почвы и низкому pH. Кольцевая нематода, Criconemoides xenoplax , была связана с комплексом болезни персикового дерева (PTSL), холодовой травмой и / или бактериальным раком ( Pseudomonas syringae ). Это широко распространенная проблема при выращивании персиков в Джорджии и Южной Каролине, но не была связана с выращиванием в Колорадо, хотя высокие популяции этой нематоды наблюдались проблемы, связанные со многими садами.Однако нельзя игнорировать возможность снижения урожайности плодов из-за этой нематоды. Мониторинг сельскохозяйственных культур, таких как плоды деревьев, особенно на легкой почве, необходим, чтобы избежать экономических потерь от этой нематоды.
Ланцовая нематода ( Hoplolaimus galeatus ): эта нематода паразитирует на большом количестве растений-хозяев, таких как пшеница, кукуруза, фасоль, горох, капуста, сладкий картофель, арахис, хризантема, яблоко, клевер, люцерна и газонные травы; но он более опасен для трав и фруктовых культур.В наших исследованиях большое количество этой нематоды наблюдалось на плодовых деревьях, на полях люцерны и газонных травах в некоторых районах Колорадо (рис. 7).
| Рис. 7. Участки некротических / мертвых растений на лужайке, связанные с большими популяциями ланцетных нематод ( Hoplolaimus spp.). |
Серьезный вредитель домашних газонов и полей для гольфа. Он встречается в Канаде, Суматре, Индии, Танзании, Центральной и Южной Америке, а также в США.S. В США это обычное явление на Восточном побережье от Новой Англии до Флориды, в бассейне реки Миссисипи (Миннесота, Висконсин, Луизиана и Колорадо), а также в Калифорнии и Техасе. Повреждению подвержены многие деревья, посевы и травы, в том числе хлопок, сосна, дуб, пшеница, кукуруза, фасоль, банан, горох, капуста, сладкий картофель, арахис, хризантема, платан, яблоко, клевер, люцерна и газонные травы. Эта нематода связана с серьезной задержкой роста и снижением жизнеспособности люцерны.
Цитрусовая нематода ( Tylenchulus spp.): Эта полуэндопаразитарная нематода вызывает серьезный ущерб (медленное снижение) цитрусовых культур и может быть проблемой для винограда, оливок и яблок. В наших исследованиях Tylenchulus обычно наблюдался в яблоневых садах в Колорадо. Молодые особи второй стадии, особенно самки, заразны. Молодь частично проникает в корни, питается там и становится самками, которые выступают из корней, при этом обнаженная часть зрелого женского тела увеличивается на поверхности корней. Эта нематода вызывает симптомы, похожие на нехватку питательных веществ, и производит грязные корни.Ущерб, причиненный нематодой Tylenchulus , выше в районах с почвами с высоким pH, например, в Колорадо. Снижает урожайность деревьев, повреждая корневую систему плодовых деревьев, особенно яблони.
Менеджмент
Управление нематодами должно быть сосредоточено на сокращении количества нематод до уровней ниже порога повреждения, а не на искоренении. Тем не менее, борьба с нематодами важна, поскольку они являются предрасполагающим фактором к заражению почвенными патогенами и стрессам окружающей среды, таким как травмы от зимних холода, весенних заморозков или засоления, и / или дефицит питательных микроэлементов.Вредоносное состояние — молодые самки, а не самцы.
- Большие популяции свободноживущих нематод могут помочь контролировать множество различных PPN в почве, поэтому обеспечьте достаточное количество органического вещества для увеличения популяций свободноживущих нематод. Если в вашей почве недостаточно свободноживущих нематод, добавьте почву с большим количеством свободноживущих нематод и обеспечьте пищу (органическое вещество) для поддержания этих нематод.
- Бархатцы, суданская трава и Brassica spp. могут использоваться в качестве сидератов для борьбы с PPN и увеличения популяций свободноживущих нематод в почве.Известно, что содержание глюкозинилата или изоктиоцианата во многих видах Brassica контролирует многие PPN.
- Соляризация почвы очень эффективна для борьбы со многими нематодами и другими почвенными патогенами. Для соляризации почвы: вспахайте поле, чтобы обеспечить рыхлость, затем обеспечьте достаточную влажность, накройте пластиком, заклейте пластик, чтобы сделать его воздухонепроницаемым, и поддерживайте герметичность не менее 45 дней в июне и июле. Комбинация вариантов 2 и 3 должна быть более эффективной. Однако соляризация почвы может оказаться неэффективной, если нематоды глубоко в почве, поскольку эти нематоды из более глубокого слоя могут вернуться обратно при вспашке.
- Химические обработки включают DiTera ES при 5-40 галлонах / A, DiTera DF при 13-100 фунтах / A, DiTera WDG при 13-100 фунтах / A или нанесение DiTera® WP или DiTera® ES, жидкий состав перед посадкой или листва растущих растений (проверьте этикетку на наличие спрея для листвы). Это хороший вариант для производителей органических продуктов. Варианты предпосадочной фумигации почвы включают Telone® C-17 при 11-17 галлонах / A, Telone® II при 9-15 галлонах / A, Vapam (метамнатрий) при 40-100 галлонах / A или Basamid 99G (дазомет) при 222 — 350 фунтов / А. Применяйте почвенные фумиганты при температуре почвы 50–80 ° F на глубине 6 дюймов при соответствующей влажности поля.Эти условия имеют решающее значение для получения эффективных результатов. Покрытие почвы после применения почвенного фумиганта увеличивает эффективность обработок. [Примечание: почвенные фумиганты обычно ограничены и доступны только сертифицированным специалистам.]
- Устойчивость хозяев: Сообщается, что многие подвои обладают устойчивостью к PPN или устойчивостью к ним. Подвой винограда 9407-14 устойчив ко многим ППН. Подвои персика, устойчивые к нематодам, включают Nemagard (корневые нематоды) и Guardian (корневые и кольцевые нематоды).Адаптивные исследования таких подвоев к нашим местным условиям продолжаются. Подвои винограда Шварцманн и Фридом были оценены как устойчивые по индексу X. , индекс .
- Комплексное использование биофумигации изучается в Западном Колорадо, особенно нацелено на повторное заражение.
Список литературы
Mai, W. F. and P. Mullin. 1975. Нематоды-паразиты растений. Иллюстрированный ключ к родам. Четвертое издание. Comstock Publishing Associates, подразделение Cornell University Press, Итака и Лондон.277 с.
Найлс, Р. К. и Г. А. Макинтайр, 1997. Обследование патогенных нематод растений в Колорадо, 1996–1997. Государственный университет Колорадо. Форт Коллинз. 20 с.
Покхарел, Р. Р. и Х. Дж. Ларсен. 2007. Важность фитопаразитических нематод и борьба с ними в фруктовых садах западного Колорадо. J. of Nema. 39: 96.
Покхарел Р. и Х. Дж. Ларсен. 2008. Растение паразитических нематод, связанных с плодовыми культурами в западном Колорадо. Стр. 22–28 В: Годин Р. (ред.). Годовой отчет Исследовательского центра Западного Колорадо — 2007, TR 07-08, Государственный университет Колорадо — сельское хозяйство.Res. Sta., Государственный университет Колорадо. Ft. Коллинз. 76 с.
Покхарел, Р. Р., Х. Дж. Ларсен, Б. Хэммон, Т. Гурд и М. Бартоло. 2009. Растение паразитических нематод, здоровье почвы и корней на луковых полях Колорадо. В: Годин Р. (ред.). Исследовательский центр Западного Колорадо, Государственный университет Колорадо. Годовой отчет, ТР 09-12: 39-44.
Покхарел и Б. Хаммон. 2008. Растение паразитических нематод, связанных с люцерной в Колорадо. Отчет об исследовании отправлен в группу генетики кормов.
* Рамеш Покхарел, Университет штата Колорадо, Исследовательский центр Западного Колорадо.(5/11)
Государственный университет Колорадо, Министерство сельского хозяйства США и округа Колорадо сотрудничают. Программы повышения квалификации доступны всем без какой-либо дискриминации. Не предполагается ни одобрения упомянутых продуктов, ни критики не упомянутых продуктов.
В начало страницы.
растений-репеллентов от нематод — узнайте о борьбе с нематодами с помощью растений
У многих садоводов были проблемы с нематодами, поражающими их растения.Может быть, вы пробовали выращивать морковь, но она вышла бугорчатой и скрученной. Или, может быть, ваш картофель был покрыт бородавками и желчью. Если это так, возможно, в вашем саду есть нематоды. Читайте дальше, чтобы узнать больше о борьбе с нематодами с помощью растений.
Использование растений для борьбы с нематодами
Нематоды — это крошечные круглые черви, которые обычно живут в почве, и многие из них атакуют садовые растения. Эти вредители могут повредить корни многих съедобных и декоративных растений, поэтому многие садоводы искали способы борьбы с ними.Если вы один из тех садоводов, вы, возможно, задавались вопросом: есть ли растения, отпугивающие нематод?
С некоторыми нематодами можно бороться с помощью уничтожающих нематод пестицидов (нематоцидов), но они могут быть токсичными, и большинство из них недоступны для домашних садоводов. Севооборот также может уменьшить заражение нематодами, но на это уходит много времени. К счастью, ученые определили список растений-репеллентов нематод, которые могут помочь в борьбе с этими обитающими на земле вредителями. К ним относятся:
- Painted Daisy — убивает нематод при использовании в качестве сидера
- Бархатцы французские — убивают нематод при использовании в качестве сидерата
- Георгин — отпугивает нематод
- Касторовая фасоль — убивает нематод при использовании в качестве сидера
- Горох гороховая куропатка — снижает популяцию нематоды сучков корня арахиса
- Рапс — некоторые сорта убивают нематод при использовании в качестве сидера
- Showy Crotalaria — убивает нематод при использовании в качестве сидера
- Velvet Bean — может отпугивать несколько видов нематод
Борьба с нематодами с помощью растений — эффективный естественный метод, который определенно стоит попробовать.
Как использовать растения-репелленты от нематод
Из приведенного выше списка двумя лучшими растениями для борьбы с нематодами являются красящая маргаритка и бархатцы. Оба эти растения не только отпугивают нематод, но и убивают нематод более эффективно.
- Окрашенная маргаритка ( Chrysanthemum coccineum ) полезна для предотвращения проблем с нематодами, поскольку она вырабатывает ботанический токсин, убивающий корневых нематод.
- Бархатцы французские ( Tagetes patula ) производят природное химическое вещество, которое убивает несколько видов нематод, в том числе нематод корневых узлов, поражающих морковь и многие другие овощные растения.
Ученые обнаружили, что мандарин, карликовая разновидность французских бархатцев, особенно эффективен в борьбе с нематодами в садовой почве. Эффективны также следующие сорта бархатцев французских:
- Болеро
- Бонита смешанная
- Голди
- Джипси Саншайн
- Маленькая
- Маленькая гармония
- Миниатюрное золото
- Скарлет Софи
- Одинарное золото
Если вы заражены нематодами, удалите как можно больше корней растений, когда будете очищать свой сад осенью.Зимой и ранней весной обрабатывайте почву и соляризуйте ее, чтобы сократить популяции нематод.
Весной посадите один из рекомендованных сортов французских бархатцев (или другое растение, отпугивающее нематод) сплошными участками или полосами в саду. Разместите растения на расстоянии семи дюймов друг от друга. Дайте им прорасти не менее двух месяцев, а затем окуните растения в почву. Обязательно возделывайте растения или удаляйте цветочные головки бархатцев, прежде чем они пойдут на семена. В противном случае они могут стать сорняком в саду в следующем году.
Чтобы нематоды не вернулись в сад, очищайте почву от сорняков до следующей весны.
Агрономия | Бесплатный полнотекстовый | Глобальные исследования нематод растений
3.1. Развитие научных результатов
Поиск в базе данных дал 17 417 документов. Из них 95% написаны на английском языке, 326 — на португальском, 231 — на китайском и 138 — на испанском. Остальные статьи написаны на других языках, таких как немецкий, французский, русский и др.Отметим, что многие нематологи США получили образование в Германии и Франции. Из 17 417 документов 14 979 (86%) — статьи и 1054 (6%) — обзоры. Остальные 8% — это доклады конференций, главы книг, заметки, редакционные статьи и другие.
Рисунок 1 показывает эволюцию количества документов по нематодам + растениям. Хотя первая статья, найденная при поиске, датируется 1893 годом, количество документов, опубликованных с этого года по 1950 год, составляет всего 36. Таким образом, на Рисунке 1 показан период с 1950 по 2019 год, последний полный год, по которому имеются данные.Можно увидеть две четко различимые тенденции. Первый — с 1950 по 1990 год. Был непрерывный годовой рост, и данные могут быть скорректированы до линейной линии тренда с R-квадратом 0,923 и наклоном 2,3. Второй период начинается в 1990 году и продолжается до сегодняшнего дня, достигнув абсолютного максимума в 2019 году, когда было опубликовано 1046 статей. Данные для этого второго тренда могут быть скорректированы для другой линейной линии тренда с R-квадрат 0,980 и наклоном 33,5.
Другими словами, интерес к предмету значительно вырос за последние 30 лет.Этот факт также подтверждается количеством журналов, публикующих статьи о нематодах + растения. Из 10 журналов, опубликовавших более 200 документов за весь анализируемый период, только два из них существовали до 1990 года. Это были Annals of Applied Biology и Nematologica (Nematologica слилась с Fundamental and Applied Nematology в 1999 году и стала Nematology). Остальные журналы появились за последние 30 лет.
3.4. Анализ ключевых слов
Были проанализированы 160 самых распространенных ключевых слов в публикациях по нематодам и растениям.Все они появляются от 231 до 6465 раз. В рамках этих ключевых слов появляются шесть культур, которым уделяется наибольшее внимание в этих публикациях. Это томат, соя, картофель, арабидопсис, кукуруза и пшеница. Известно, что Arabidopsis thaliana не является растительной культурой, но он используется во многих различных типах исследований, включая предметы, связанные с нематодами, паразитирующими на растениях. Все они были проанализированы в зависимости от страны, в которой были опубликованы работы, в которых они опубликованы, и результаты показаны на Рисунке 5.Томат (Solanum lycopersicum) привлекает наибольшее внимание в связи с их взаимоотношениями с нематодами. Фактически, это имеет место в 6 из 16 стран, которые публикуют больше всего по этой теме: Китай, Индия, Испания, Италия, Египет и Южная Африка. Второй по значимости культурой была соя (Glycine max). Однако в США этой культуре уделяется большое внимание: об этой культуре опубликовано более 500 публикаций. Это означает, что в 2 из 3 опубликованных в мире статей о сое и нематодах участвуют американские авторы и учреждения, что дает представление о важности этой культуры для страны.Бразилия — вторая страна, где относительный вес публикаций по сое и нематодам выше, чем по другим культурам. США и Бразилия являются двумя ведущими странами в мировом производстве сои, культуры, которая с каждым годом становится все более востребованной во всем мире с экономической и пищевой точек зрения, поскольку является отличным источником белка.
Исследования картофеля (Solanum tuberosum) и их связи с нематодами являются наиболее важными в Соединенном Королевстве, Нидерландах и Канаде, в то время как исследования Arabidopsis thaliana наиболее важны в Германии, Франции, Бельгии и Японии.
Пшеница (Triticum aestivum) — пятая по значимости культура и та, по которой в Австралии было опубликовано большинство исследований по нематодам. Более 20% статей о пшенице и нематодах были опубликованы австралийскими авторами или учреждениями. Важность этой культуры для Австралии обусловлена тем, что пшеница выращивается более чем на половине сельскохозяйственных угодий страны и является ключевым экспортным продуктом, при этом Австралия становится четвертым по величине экспортером пшеницы с объемом более 10 миллионов тонн к 2019 году.
С другой стороны, эти шесть культур также были изучены в отношении нематод, которые чаще всего встречаются в этих публикациях (рис. 6), согласно анализу ключевых слов. Двумя наиболее известными видами являются Meloidogyne javanica и Meloidogyne incognita, каждый из которых фигурирует в более чем 1900 статьях. Большинство этих статей посвящено посевам томатов. Нематоды семейства Meloidogynidae в основном поражают эту культуру, вызывая образование галлов в корнях, влияя на ее функциональность, изменяя абсорбцию воды и транспорт питательных веществ.Третий вид в этом семействе — Meloidogyne hapla, и хотя он появляется среди семи видов с наибольшим присутствием, его относительная важность не так высока, как у двух предыдущих видов. Следующий вид — Heterodera glycines, нематода, поражающая в основном соевые бобы. Следующие два вида — Globodera rostochiensis и Globodera pallida — нематоды, поражающие в основном посевы картофеля. Последним появившимся видом нематод является Heterodera schachtii. В основном это связано с сахарной свеклой и Arabidopsis thaliana.Это связано с тем, что эта система Heterodera schachtii / Arabidopsis thaliana стала мощной и универсальной исследовательской моделью для изучения и характеристики возможных взаимодействий между цистовыми нематодами и растениями, на которые они влияют [22]. В дополнение к этому, есть два других вида нематод, которые не имеют такого заметного общего значения, но влияют на определенные культуры, и по ним было опубликовано множество исследований. Это Bursaphelenchus xylophilus, поражающий в основном сосновые плантации, и Radopholus similis, поражающий банановые плантации.По ним опубликовано 164 и 133 публикации соответственно. В этом списке представлены только наиболее часто цитируемые нематоды; другие нематоды не появляются, хотя они влияют на такие важные сельскохозяйственные культуры, как апельсиновые деревья [23], которые представляют большой экономический и агрономический интерес. Наконец, динамика количества публикаций в год по основным направлениям исследований была проанализирована через 160 ключевые слова (рисунок 7). Направления исследований и связанные с ними ключевые слова в скобках: устойчивость растений (устойчивость, устойчивость к болезням, трансгенное растение и РНК-интерференция), вирулентность нематод (вирулентность), филогения и таксономия (классификация, таксономия, филоген и морфология), почва. биоразнообразие (биоразнообразие, структура сообщества, почвенная фауна, разнообразие видов, экология и численность), биоиндикаторы (структура сообщества), интегрированная борьба с вредителями или IPM (борьба с вредителями), биологическая борьба (биологическая борьба, биологическая борьба с вредителями, глистогонный агент, антинематодный агент) и биоконтроль), нематоциды (глистогонная активность, глистогонные средства, глистогонное средство, противогельминтное средство и нематоцид), биопестициды (глистогонная активность, глистогонные средства, глистогонное средство, антинематодное средство, растительный экстракт и лекарственное растение) и взаимодействие хозяин-паразит ( взаимодействие паразитов, взаимодействия хозяина-паразита, паразитизм, взаимодействие хозяин-паразит, экспрессия генов, регуляция экспрессии генов).Как можно заметить, различные направления исследований могут быть сгруппированы в направления исследований с высокой научной производительностью (биологический контроль и взаимодействие паразит-хозяин), направления исследований со средним научным производством (устойчивость растений, филогения и таксономия, биоразнообразие почвы, нематоциды и т. Д.). биопестициды), а также направления исследований с низким уровнем научного производства (IPM, биоиндикаторы и вирулентность нематод).
Большая часть этой научной продукции проводилась с 2010 года, и именно в период 2010–2019 годов направления исследований в области биологической борьбы были сосредоточены на альтернативе, которую эта методология представляет химическим нематицидам и другим традиционным методам борьбы, и Взаимодействие хозяин-паразит, сфокусированное на отношениях между паразитом и растением, вызывало больший интерес.Другие направления исследований оказались более интересными в разные периоды, но не сейчас. Например, это относится к исследованиям IPM, которые привлекли внимание научного сообщества в конце 20-го века, или направлениям исследований, сосредоточенных на нематицидах или биопестицидах, которые представляли наибольший интерес в конце 20-го века. 1980-е годы.
Нематоды, паразитирующие в растениях — Новости продукции для теплиц
Диагностика нематод и борьба с ними в травянистых многолетниках.
Нематоды — одни из самых многочисленных многоклеточных животных на Земле. Они существуют во множестве экологических взаимосвязей и могут быть обнаружены почти в каждой доступной экологической нише, от Арктики до пустынь или глубин океанов. Горстка почвы может содержать многие тысячи этих микроскопических червей. Большинство из них являются свободноживущими видами, которые питаются бактериями, грибами, водорослями или другими нематодами. Многие из них паразиты насекомых, растений или животных. Большинство нематод невозможно увидеть без микроскопа, но некоторые паразиты животных могут быть измерены в метрах.
Нематоды, с которыми цветоводы и садоводы больше всего знакомы и которые вызывают беспокойство, — это нематоды, паразитирующие на растениях. Они просты и состоят всего из 1000 соматических клеток в форме тела «трубка в трубке». Наружная трубка — это внешняя стенка тела или кутикула, а внутренняя трубка — это пищеварительный тракт, который простирается от переднего рта до заднего прохода возле хвоста. У нематод, паразитирующих на растениях, есть стилет, похожий на копье ротовой аппарат, используемый для прорезания или прокалывания растительных клеток. Они обладают пищеварительной, нервной, выделительной и репродуктивной системами, но не имеют кровеносной или дыхательной систем.Они не могут видеть, поэтому они находят путь через почву к хозяевам с помощью физических сигналов и химических рецепторов.
Нематоды, паразитирующие на растении, живут в водных пленках в почве или в таких частях растений, как корни, стебли и листья, и вокруг них. Они могут быть обычными питающимися или иметь очень специфические отношения паразит-хозяин с ограниченным числом растений-хозяев. Борьба с нематодами, паразитирующими на растениях, является сложной задачей во многих системах земледелия, но может быть особенно сложной задачей в отношении декоративных растений по ряду причин.Многолетние травянистые растения представляют собой разнообразную группу, состоящую примерно из 2500 видов примерно 500 различных родов. Эта разнообразная группа растений может быть весьма ценной: только в Соединенных Штатах годовая валовая выручка составила около 1 миллиарда долларов в 1994 году. Кроме того, многолетние растения размножают несколькими способами, включая семена, деление и черенкование. Часто предпочтительнее использовать вегетативные методы размножения, такие как деление, так как они проще и могут давать более качественные и однородные растения, а также уменьшать вариативность внутри сортов.К сожалению, вегетативное размножение может привести к непреднамеренному размножению небольших популяций нематод, паразитирующих на растениях, на бессимптомных растениях, увеличивая распространение и распространение этих нематод и масштабы проблем с нематодами.
Нематоды-вредители
Северная нематода корневого узла, Meloi-dogyne hapla, является наиболее важным патогеном нематод, поражающим широкий спектр цветущих травянистых многолетних растений на севере США и в Канаде. Клубневые нематоды — это малоподвижные эндопаразиты, что означает, что они остаются в одном месте, питаясь богатыми питательными веществами клетками, в которых они зарождаются внутри корня.Молодь вылупляется из яиц; заражают корни, обычно около кончиков корней; установить питательные клетки, которые приводят к образованию корневых галлов; и превращаются в опухших самок. Эти самки производят большое количество яиц в яичных массах, которые производятся вне женского тела. Симптомы инфекции корневых узлов включают галлы разного размера, чрезмерное ветвление корней и опухшие кончики корней. Над землей растения часто отстают в росте, имеют блеклый цвет и проявляют симптомы плохой корневой функции. Meloidogyne hapla вызывает особую озабоченность в северной части Соединенных Штатов и Канады, поскольку этот вид может легко перезимовать, и со временем его численность на многолетних растениях в этих районах увеличится.
Листовые нематоды, паразитирующие на растениях, также могут нанести серьезный ущерб большому количеству цветущих декоративных растений в питомниках и ландшафтных насаждениях. Спектр симптомов, наблюдаемых на цветущих декоративных растениях, может значительно варьироваться в зависимости от видов растений и нематод, но листья, стебли, цветы или бутоны обычно искажаются, затмеваются и погибают. Есть две разные нематоды, паразитирующие на растениях, которые могут атаковать надземные части растений. Наиболее распространенная листовая нематода Aphelenchoides fragariae была внесена в список как способная поражать более 250 растений из 47 семейств, в том числе многие цветущие декоративные растения.Ditylenchus dipsaci, стеблевая и луковичная нематода, обнаружена у более чем 450 растений-хозяев, включая как однодольные, так и двудольные. Обе эти нематоды широко распространены и могут быстро испортить листву и цветы.
Aphelenchoides spp., Общее название листовых нематод, представляют собой микроскопические червеобразные нематоды длиной 0,018-0,047 дюйма. Эти мигрирующие нематоды обычно питаются внутри листвы. В зависимости от растения-хозяина кормление нематодами может вызывать некротические поражения, ограниченные прожилками, у таких культур, как хоста или сальвия, или бронзовое покрытие и обесцвечивание листвы у таких культур, как бегония и анемон.Поврежденные листья со временем полностью или частично пересыхают. Внекорневые нематоды могут годами пережить иссушение и могут выжить без хозяина или рассредоточиться в сухой мертвой ткани. При регидратации заражение растений происходит после перемещения нематод в водяных пленках или водяных брызг. Гибнут нематоды в водных пленках на быстро высыхающих поверхностях; столь длительные периоды влажности листьев увеличивают распространение и выживаемость нематод во время движения. Попав внутрь новых листьев, размножение происходит быстро. Самки откладывают 25-32 яйца каждое, из которых вылупляются в течение 3-4 дней и созревают за 6-12 дней, завершая весь жизненный цикл примерно за две недели.
Ditylenchus dipsaci, стеблевые и луковичные нематоды, червеобразные, и взрослые особи имеют длину 0,031–0,055 дюйма. Эти нематоды могут инфицировать ткани стебля, листа и почек, вызывая опухоль, деформацию и некроз. Инфекция стеблевых и луковичных нематод часто маскируется инфекцией, вызванной вторичными патогенами, такими как Botrytis, распространенный вторичный грибок Phlox subulata. Эти нематоды могут жить в широком диапазоне температур, 41-86 ° F, хотя оптимальная температура составляет 59-68 ° F. Самки Ditylenchus откладывают 8-10 яиц в день, всего 200-500 яиц на самку.Молодь проходит через одну линьку в яйце, вылупляется и линяет еще три раза, прежде чем стать взрослой. Весь жизненный цикл можно пройти за 19-23 дня.
В ходе многочисленных исследований во всем мире были обнаружены листовые нематоды на однолетних и многолетних цветках. Недавно мы извлекли листовые нематоды Aphelenchoides и Ditylenchus из полевых и горшечных питомников в Коннектикуте, Массачусетсе и Нью-Йорке. Aphelenchoides является повторяющейся проблемой для нескольких видов растений, и недавно был идентифицирован ряд новых хозяев.Дитиленхи представляют собой особую проблему для цветущих многолетников Phlox subulata. Обе нематоды могут быстро увеличивать популяции до огромных количеств на листе, а отдельные или засохшие листья могут рассеивать популяции. Инфекция может быстро стать обширной и разрушительной. Обе нематоды могут длительное время выживать в высушенных растительных остатках.
Лечение
Концепция начальных пороговых уровней повреждения, а именно, что степень повреждения роста растений является результатом количества нематод, присутствующих при посадке, не может применяться к нематодам, поражающим многолетние растения.Низкая начальная плотность нематод может значительно увеличиться на восприимчивых многолетних хозяевах после года посадки и со временем вызвать повреждение.
По этой причине борьба с корневыми нематодами у многолетних растений представляет собой особую проблему. Раньше борьба с нематодами в ценных декоративных растениях означала использование системных нематицидов, таких как альдикарб или оксамил. В связи с отсутствием в настоящее время вариантов управления помеченными нематодами необходимы программы управления питомниками и ландшафтными нематодами на основе санитарии и ротации.Санитария, осуществляемая путем выявления и уничтожения посадочного материала, зараженного M. hapla, и чередования с видами, не являющимися хозяевами, может быть эффективной, особенно для многолетних растений, выращиваемых в полевых условиях, хотя для успешного использования севооборота необходимы знания о статусе растения-хозяина большого числа растений. виды растений. Пригодность хозяина M. hapla почти 100 обычным многолетним растениям, выращиваемым на Северо-Востоке, была исследована и опубликована. Кроме того, мы определили, что обрезка корней необожженного посадочного материала может значительно уменьшить или устранить M.hapla и снизить потенциальное распространение нематод. Посадка устойчивых растений, таких как Rudbeckia fulgida или астра, в почвы, зараженные M. hapla, также может сократить или в конечном итоге уничтожить популяции этой нематоды. Борьба с нематодами на листовых частях растений может быть чрезвычайно сложной. Диагностика растений с листовыми нематодами часто затрудняется дополнительным заражением грибковыми патогенами, такими как Botrytis cinerea. Питательные и тепличные культуры практически не переносят, так как любой зараженный нематодами материал обычно приводит к акклиматизации и распространению нематод.Санитария, предотвращение и управление поливной водой могут помочь замедлить распространение листовых нематод, но химические нематоциды, зарегистрированные для борьбы с нематодами после посадки, не зарегистрированы. Это отсутствие вариантов контроля может быть причиной недавнего увеличения частоты диагностированных заражений листовыми нематодами на северо-востоке.
Инсектициды
В ходе серии экспериментов, проведенных в течение нескольких лет, мы определили, что некоторые инсектициды, применяемые для внекорневой обработки, обладают ограниченной активностью против нематод.Avid (Syngenta Professional Products) предназначен для использования на декоративных растениях для борьбы с клещами и миньонами и ранее продемонстрировал некоторую активность против нематод как корневых узлов, так и листовых нематод. Было показано, что авермектины обладают нематицидным действием, снижая инфекционность нематод, вывод, поглощение кислорода и подвижность нематод. Диазинон (компания Gowan) указан как средство борьбы с некорневыми нематодами в Корнельских рекомендациях по интегрированному управлению выращиванием цветов в теплицах, но информации об эффективности мало.Pylon (Olympic Horticultural Products), clorfenapyr, предназначен для борьбы с некорневыми нематодами в теплице.
В наших экспериментах применение Avid к листве с двумя дозами (5,6 или 11,2 ppm ai) в одно или два применения каждой нормы уменьшало количество нематод, выделенных из листвы Lamium maculatum, но не устраняло их. Не было различий в эффектах двух доз, обозначенных для паутинных клещей или минеров, соответственно, и фитотоксичности не наблюдалось. Не было различий в эффективности между одним или двумя приложениями Avid с интервалом в одну неделю.Ditylenchus dipsaci у Phlox subulata частично контролировались с помощью до четырех еженедельных применений Avid или Diazinon. Ни Авид, ни Диазинон полностью не контролировали нематод стебля и луковицы Ditylenchus даже после четырех применений. Существенных различий между Авидом и Диазиноном не выявлено. В дополнительных экспериментах в теплице, Pylon и Avid при нормировании нормы показали некоторую активность против листовых нематод, но контроль был неполным, и результаты между экспериментами не соответствовали.
Управление большими популяциями нематод с помощью инсектицидов будет чрезвычайно трудным, особенно в свете высокого репродуктивного потенциала и низкой толерантности к этим патогенам в коммерческом производстве.Было бы легче достичь и поддерживать контроль над малочисленными популяциями. Таким образом, интеграция химикатов, подавляющих нематоды, таких как Avid, Pylon или Diazinon, в листву в сочетании с тактиками культурного контроля, такими как санитария, удаление больных растений или тканей из урожая или между посадками, а также исключение зараженных частей растений из компоста. геморрой; изменение окружающей среды, такое как управление влажностью листьев за счет уменьшения частоты полива сверху; и увеличение воздушного потока через культуру будет необходимо для борьбы с инфекцией листовых нематод.
Обработка корневых узлов на травянистых многолетних культурах также должна быть многогранной и может включать: отбор свободного от патогенов материала для размножения, снижение бессимптомных инфекций низкого уровня путем обрезки кончиков корней при размножении и чередование на не-хозяин.
