создаём в аквариуме условия, приближенные к природным
Содержание:

Для создания условий жизни водных обитателей в аквариуме аквариумисту необходимы знания биологических процессов, которые происходят в нашем искусственном водоеме. Пример таких процессов находим в природе.
Техногенные факторы, которыми человек воздействует на природу, уже привели к исчезновению некоторых разновидностей животных рыб и растений, которые содержатся ныне только в искусственной среде. И поэтому важно сохранить исчезающие виды хотя бы в условиях аквариума.
Задача аквариумиста — постараться создать условия в аквариуме, приближенные к природным. Тогда водные обитатели проявят палитру красок, порадуют бойким поведением, аппетитом и конечно же дадут потомство.
Роль кислорода в живой природе
Еще с начальной школы известно, что для живых организмов на Земле кислород — жизненный элемент первой необходимости, так как живые организмы дышат, поглощают кислород.
Поступая в клетки тела животного или растения, кислород вступает в реакцию с выделением энергии которая идет на те или иные жизненные процессы и углекислого газа (СО2), который выводится из организма, так как действует как яд.
Понять механизмы дыхания рыб и водных растений можно, разобравшись в реакциях растворения кислорода и углекислого газа в воде.
Основные газы, растворенные в воде и их соотношение в частях:
|
углекислый газ |
кислород |
азот |
|
70 |
2 |
1 |
Количество газов в воде пропорционально показателям растворимости. Растворенные газы присутствуют в воде, поступая из атмосферного воздуха, или образуются непосредственно в аквариуме. Кислород образуется в результате фотосинтеза, при наличии живых растений в аквариуме, а в отсутствии растений — только из атмосферного воздуха и благодаря аэрации.
Для кислорода коэффициент диффузии в воздухе равен 11, а в воде — 0,000034 или в 320 000 раз ниже! А это означает, что условия для добывания кислорода у водных организмов намного хуже, чем у наземных.
Сколько кислорода может раствориться в воде?
В воде содержание кислорода в 20-30 раз меньше, чем в том же объёме воздуха. Количество кислорода, который растворяется в воде, называется нормальным. Коэффициент растворимости кислорода при 0 °С равен 0,04898 и в случае нормального давления этого газа, равного 60 мл рт.ст. (210 мл О2 в 1л. воздуха), в 1 л. воды будет растворено -210*0,04898=10,29 О2). С повышением температуры и солёности воды коэффициент растворимости уменьшается, и нормальное количество кислорода снижается.
При температуре 10°С максимальная растворимость кислорода составляет 11,3 мг/л, при 25°С -8,2мг/л, а в морской воде, при 25°С -4,8 мг/л. Содержание кислорода в аквариуме определяется равновесием между потреблением (окисление органики, дыхание) и пополнением (фотосинтез, аэрация, поверхностная диффузия). Понятно, что потребление кислорода связано с количеством аэробных (потребляющих кислород) организмов, чем аэробов больше, тем быстрее потребляется кислород.
Для всех ли аквариумов необходимо аквариумное оборудование?

В результате диффузии в стоячей воде молекула кислорода погружается на 1 см за час. В течение суток без перемешивания воды молекула не дойдет до дна аквариума, и, соответственно, не обеспечит необходимого содержания кислорода у дна аквариума, где живут аэробные микроорганизмы. Поэтому модные аквариумы-шары с лабиринтовыми рыбками при возможном перекорме рыбы лишаются нужных бактерий, некому перерабатывать остатки корма и экскременты, параметры воды скачут, рыбы слабеют и погибают!
Такие ситуации часто встречаются у новичков, которые упорно верят, что в аквариумах с лабиринтовыми рыбками не нужна никакая техника. Лабиринтовые рыбки дышат атмосферным кислородом, но бактерии — нет.
Кто потребляет кислород в аквариуме?
Потребляют кислород рыбы, растения и бактерии. Бактерии живут в аквариуме и влияют на содержание кислорода, а численность бактерий регулируется количеством органического вещества в аквариуме.

В аквариумах, в которых регулярно проводится очищение грунта, удаляются излишки органических веществ, содержание кислорода выше по сравнению с аквариумами, загрязненными органикой. Запущенные аквариумы с большим количеством ила на дне похожи по происходящим биологическим процессам на озера эвтрофного типа. Во время летней и зимней стагнации в озерах кислород в дефиците, и в придонном слое создаются анаэробные (бескислородные) условия. В старом аквариуме верхний слой грунта с большим количеством органики еще содержит кислород, а нижний слой, как в случае с эвтрофным озером, переходит в анаэробную зону, а это чревато образованием сероводорода и метана, крайне опасных газов.
В природных условиях: в реках, ручьях из-за постоянного перемешивания воды зон с резким недостатком кислорода нет. Поэтому подбирая фильтрующую технику для нашего аквариума, обратите внимание на производительность, пусть фильтр пропускает через себя минимум 2-3 объема аквариума в час.
Аквариумные рыбы и кислород

По отношению к кислороду водные организмы делятся на эвриоксибионтных (выживают при колебаниях уровня кислорода) и стенооксибионтных (колебания кислорода исключаются).
Концентрация кислорода, необходимая для нормальной работы органов рыбы, определяется:
-
Размером рыбы (чем рыба больше, тем рыбе нужно больше кислорода).
-
Возрастом (скорость и уровень обмена веществ различается у старой и молодой рыбы).
-
Физиологическим состоянием (в стрессе, например, во время транспортировки, потребление кислорода возрастает).
Потребность в кислороде выше у тех рыб, которые в природе живут в бурных реках или подвижны. Например, Данио и Рерио. Минимальная необходимая концентрация для этих рыб кислорода составляет 5мг/л.
Данио легко переносят понижение содержания кислорода, так как держатся преимущественно в верхнем слое воды, где содержание кислорода выше.
Понаблюдав за теми же Данио, замечаешь, что, если рыбки опускаются до дна аквариума и весело резвятся, используя толщу воды — содержание кислорода будет приемлемо и для других рыб.
Для малоподвижных рыб, например, сомика агамиксиса, концентрация кислорода 1мг/л достаточна.
Обмен веществ у рыб и других пойкилотермных животных определяется температурой окружающей среды, и, чем теплее, тем обмен веществ быстрее, и соответственно, требуется большее количество кислорода.
Например, карпы кои в пруду при температуре воды 3 °С потребляют 8 мг. кислорода на килограмм веса, а при 25 °С — 240 мг.
При содержании рыб в аквариумах, поддерживайте достаточное содержание кислорода и снижайте уровень углекислого газа (если это не аквариум-травник).
Приборы обеспечения аквариумов кислородом
Добивайтесь этого путем простой аэрации при помощи компрессора и распылителя, дающего наименьшие по диаметру пузырьки. Чем меньше диаметр пузырька, тем медленнее кислород поднимается к поверхности воды, и, значит, увеличивается время диффузии, кислород лучше и быстрее насытит воду кислородом.
Рекомендуется устанавливать распылитель у выхода фильтра, так, чтобы пузырьки захватывались током воды и разносились по аквариуму, тем улучшается растворимость кислорода.

В аквариуме-травнике с большим количеством растений старайтесь создать условия для фотосинтеза — яркий свет, дополнительная подача углекислого газа, внесение удобрений. В результате сами растения выделяют такое количество кислорода, что растения, словно жемчугом покрыты пузырьками кислорода. Но правильно рассчитывать количество рыб на объем аквариума при этом так же важно.
Зависимость кислородного оборудования аквариума от электричества
В этом материале рассмотрен третий из этапов подготовки в аквариуме приближенных к природным условий:
1. Правильно подобрано количество рыбы для аквариума.
2. Установлено фильтровальное оборудование.
Но задействованные в поддержании биологического равновесия приборы питаются электричеством… Если произойдет отключение электросети, аэрация, фильтр, свет перестанут функционировать. Микроорганизмы, о которых позаботились при запуске аквариума, пострадают и даже погибнут. Аэробные бактерии гибнут уже через два часа, и это в фильтре, в котором малое количество органики! В «грязном» фильтре процесс гибели бактерий происходит быстрее, окисляется органическое вещество, в канистре фильтра кислород «улетает» очень быстро!
Предупредить отключение подачи кислорода помогут источники бесперебойного питания для аквариумного оборудования серии AQUASKAT. Предназначены эти бесперебойники для внутренних и внешних фильтров, компрессоров, насосов и характеризуются напряжением 220 В, мощностью 50 ВА — 1000 ВА. При отключении электричества, пропадании сети, происходит автоматический переход на резервное питание от аккумулятора, встроенного или внешнего.
Источники бесперебойного питания AQUASKAT

AQUASKAT AS-UPS 50+ — автоматический переход на резервное питание от аккумулятора (поставляется отдельно) при пропадании сети. Корпус рассчитан под установку аккумулятора 7 Ач. Есть возможность установки внешнего аккумулятора (время резерва до нескольких суток).
AQUASKAT AS-UPS 50 Li-ion — автоматический переход на резервное питание от встроенного Li-ion аккумулятора. Прерывистый режим работы продлевает время автономной работы.
AQUASKAT AS-UPS 250+ — ИБП для аквариумного оборудования с большим потреблением электроэнергии. Автоматический переход на резервное питание от аккумулятора (поставляется отдельно) при пропадании сети. Корпус рассчитан под установку аккумулятора до 40 Ач. Возможность включения и выключения прерывистого режима работы.
AQUASKAT AS-UPS 1000 — автоматический переход на резервное питание от аккумулятора (поставляется отдельно) при пропадании сети. Необходимое количество аккумуляторов — 2 штуки, ёмкостью от 40 Ач до 200 Ач.
Внимание! Для питания аквариумного оборудование не допускается использование компьютерного UPS!
Для этого есть две причины:
- Форма выходного напряжения. Для питание аквариумного оборудования в состав которого входит электродвигатель (компрессор, аэратор, фильтр и прочие) не допускается подавать напряжение в форме меандра! Это приводит к повышению шума, увеличению износа, перегреву и, как следствие, к выходу из строя.
- Малое время резерва. Обычный UPS предназначен для корректного завершения работы компьютера при отключении электричества, и время резерва составляет порядка 5-10 минут. Такой резерв не спасет обитателей аквариума при серьезной аварии в электросети.
Серия AQUASKAT AS-UPS разработана специально для аквариумного оборудования и имеет на выходе чистый синус для корректной работы электродвигателей и обеспечивает продолжительное время резерва, при отключении электричества, более 8 часов.
Где купить
Купить недорого надежный термостат производства «Бастион» Вы всегда можете в магазинах фирменной сети «Скат» в городах Москва, Санкт-Петербург, Ростов-на-Дону, Новосибирск.
Читайте также:
skat-ups.ru
Кислород в воде
Кислород вместе с другими газами, входящими в состав воздуха, легко растворяется в воде.
Сколько же воздуха может раствориться в воде? Говорить о растворимости воздуха в целом нельзя, нужно говорить о растворимости каждой составной части воздуха в отдельности.
Кислород, азот, аргон, двуокись углерода и другие газы обладают различной растворимостью. При одинаковых температуре и давлении чистого кислорода в воде растворится почти в 2 раза больше, чем азота, а углекислого газа — в 35 раз больше, чем кислорода.
Однако существуют общие закономерности для всех газов. Чем выше температура жидкости, тем меньше растворимость газов. В литре чистой воды при нормальном атмосферном давлении, равном 760 миллиметрам ртутного столба, и при температуре 0° растворяется около 50 кубических сантиметров чистого кислорода. А при температуре 30° — примерно в 2 раза меньше. Чистого азота при температуре 0° и нормальном атмосферном давлении растворится 24 кубических сантиметра, а при температуре 30°—14 кубических сантиметров.
Чем выше давление газа над жидкостью, тем больше его растворимость.
Если в закрытом сосуде, наполненном на одну треть водой, создать давление в 2 атмосферы, то газа растворится вдвое больше, чем при 1 атмосфере. И, наоборот: при пониженном давлении газа растворится во столько же раз меньше, во сколько ниже давление.
Два равных объема различных газов, смешанных при давлении в 1 атмосферу, растворяясь в воде, будут вести себя как два самостоятельно существующих газа, находящихся под давлением в У2 атмосферы. Растворимость каждого из них будет в 2 раза меньше их растворимости при нормальном атмосферном давлении.
Воздух — это смесь газов. Так как в воздухе содержится 21 процент кислорода, то его парциальное давление, то есть та часть давления, которая падает только на кислород, будет в 5 раз меньше давления воздуха. Поэтому кислорода воздуха при нормальном атмосферном давлении растворится в воде в 5 раз меньше, чем чистого кислорода при том же давлении.
В самом деле, если при нормальном давлении и при температуре 0° насытить воду не чистым кислородом, а воздухом, то в литре воды растворится только 10 кубических сантиметров кислорода вместо 50, а азота из воздуха растворится 19 кубических сантиметров вместо 24.
В воде, содержащей различные соли, растворимость газов снижается. В речной воде кислорода растворяется меньше, чем в чистой (дистиллированной), а в морской меньше, чем в речной.
Чтобы растворить газ в воде, его нужно привести в соприкосновение или перемешать с водой; чтобы вытеснить газ из воды, воду нужно подогреть. Доведя температуру воды до 100°, можно почти полностью вытеснить из нее газ.
Возьмите колбу, наполненную доверху водой, закройте ее пробкой, в которую вставлена загнутая стеклянная трубка. Второй конец этой трубки вставьте в стакан с водой и наденьте на этот конец трубки наполненную водой пробирку. Доведите воду в колбе до кипения. В опрокинутой пробирке появится газ, тот самый газ, который был растворен в воде до ее кипячения.
Хотя до кипячения вода соприкасалась только с воздухом, но в силу различной растворимости кислорода и азота состав вытесненного газа будет существенно отличаться от состава обычного воздуха. В него входит 1 объем кислорода и 2 объема азота. А это означает, что в полученном газе кислорода уже не 21, как в воздухе, а 33 процента.
В обыкновенной, неочищенной воде, кроме растворенного газо
www.activestudy.info
Растворимость воздуха в воде. Деаэрация. Закон Генри. Коэффициенты Генри для воздуха.
Растворимость воздуха в воде. Деаэрация. Закон Генри. Коэффициенты Генри для воздуха.
Количество воздуха, способного к растворению в воде — снижается при повышении температуры и повышается при повышении давления.
Деаэрация.
При нагревании пресной воды начинают формироваться воздушные пузырьки. Как известно, вода не может удерживать растворенный воздух при повышении температуры. При 1 баре и температуре 100 0C (2120F) вода закипает и тогда уже водяной пар формирует пузырьки. Если быстро охладить воду, а потом снова ее нагреть, пузырьки не появятся до тех пор пока вода не закипит. Вода деаэрирована.
Растворимость.
Растворимость воздуха может быть выражена через соотношение:
Sa = ma/ mw
где
Sa = массовая доля растворимого воздуха в воде
ma = масса воздуха (кг)
mw = масса воды (кг)
Закон Генри.
Процесс растворения воздуха в воде подчиняется закону Генри, который гласит: «При постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором (равна давлению в растворе).» — В символьном виде закон может быть записан как:
c = k H pg
где
c = концентрация газа в растворе
k H = коэффициент Генри
pg = парциальное давление газа над раствором
Растворимость кислорода в воде выше растворимости азота. Воздух, растворенный в воде содержит приблизительно 35,6 % кислорода по сравнению с 21% долей в обычном воздухе.
Пример — Расчет количества воздуха, растворенного в воде.
Количество воздуха, растворенного в воде может быть посчитано, исходя из закона Генри.
Коэффициенты Генри при температуре окружающей среды 25oC (77oF)
* Кислород — O2 : 756.7 атм/(моль/л)
* Азот — N2 : 1600 атм/(моль/л)
Молярные веса
* Кислород — O2 : 31.9988 г/моль
* Азот — N2 : 28.0134 г/моль
Относительное содержание (по объему) в воздухе:
* Кислород — O2 : ~ 0.21
* Азот — N2 : ~ 0.79
Объем кислорода, растворенного в воде при атмосферном давлении может быть посчитан как :
co = (1 атм) 0.21 / (756.7 атм/(моль/л)) (31.9988 г/моль)
= 0.0089 г/л
~ 0.0089 г/кг
Объем азота, растворенного в воде при атмосферном давлении может быть посчитан как:
cn = (1 атм) 0.79 / (1600 атм/(моль/л)) (28.0134 г/моль)
= 0.0138 г/л
~ 0.0138 г/кг
Поскольку воздух-это сумма кислорода и азота :
ca = (0.0089 г/л) + (0.0138 г/л)
= 0.0227 г/л
~ 0.023 г/кг
Таблица. Количество (масса) воздуха, растворенного в воде при различных давлениях и температуре 25oC (77oF):
|
Абсолютное давление (атм) |
1 |
2 |
3 |
4 |
5 |
6 |
| Объем растворенного в воде воздуха при 250C (г/кг) | 0,023 | 0,045 | 0,068 | 0,091 | 0,114 | 0,136 |
Рисунок. Растворимость кислорода в пресной воде при 1 атм в зависимости от температуры.
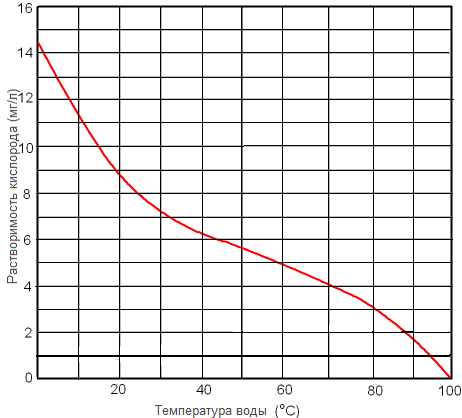
Деаэрация
Для максимальной деаэрации вода должна быть нагрета до 2120F (1000C) при атмосферном давлении. Это обычное инженерное решение для паровых систем, где пресная вода подается в систему через нагретый деаэратор наверху конденсатоприемника.
Также обычным решением является установка деаэрационных устройств с горячей стороны теплообменника в отопительных системах для интенсификации удаления растворенного воздуха из системы.
Поскольку максимум деаэрации приходится на минимум статического давления и максимум температуры в системе, то наилучший результат деаэрации достигается в верхних точках систем относительно уровня земли и/или на входе насоса.
tehtab.ru
Растворимость кислорода в пресной и соленой воде.
Растворимость кислорода в пресной и соленой воде. Диапазон давления 1-4 бара абсолютного давления.
Растворимость кислорода воздуха в пресной и соленой (морской) воде. Диапазон давления 1-4 бара абсолютного давления.
Растворимость кислорода в в смеси воздуха в пресной и соленой воде при диапазоне атмосферного давления от 1 до 4 бар абсолютного давления представлениа на диаграмме.
Соленость не везде одинаковая, она зависит от расположения и глубины. Вода, соленость которой средняя между между пресной водой и морской, соленой называется слабоминерализированной (слабоминерализованной).
Соленость воды в океанах и морях варьируется от 30 до 50 промилле (тысячных частей, pptw), в среднем 35 pptw. — 35 г растворенной соли/кг соленой воды =35 pptw =35 o/oo=3.5 %=35,000 ppmw.
Рисунок. Раствоимость кислорода в пресной и соленой воде при 1,2и 4 атм в зависимости от температуры.

Таблица. Растворимость кислорода в пресной воде. Соленость ~ 0.
|
Давление |
мм рт.ст. |
760 | 1520 | 3040 | ||||||
| 14.7 | 29.3 | 58.7 | ||||||||
|
бары |
1 | 2 | 4 | |||||||
|
кПа |
101.1 | 202.2 | 404.3 | |||||||
|
Температура |
Растворимость |
|||||||||
|
oC |
oF |
μ Моль (микромоль) |
мг/л |
мл/л |
μ Моль (микромоль) |
мг/л |
мг/л |
μ Моль (микромоль) |
мг/л |
мл/л |
| 0 | 32 | 457 | 14.6 | 10.2 | 913 | 29.2 | 20.5 | 1823 | 58.4 | 40.9 |
| 5 | 41 | 399 | 12.8 | 9.1 | 798 | 25.5 | 18.2 | 1595 | 51.1 | 36.4 |
| 10 | 50 | 353 | 11.3 | 8.2 | 705 | 22.6 | 16.4 | 1411 | 45.1 | 32.8 |
| 15 | 59 | 315 | 10.1 | 7.5 | 630 | 20.2 | 14.9 | 1260 | 40.3 | 29.8 |
| 20 | 68 | 284 | 9.1 | 6.8 | 568 | 18.2 | 13.7 | 1137 | 36.4 | 27.3 |
| 25 | 77 | 258 | 8.3 | 6.3 | 517 | 16.5 | 12.6 | 1034 | 33.1 | 25.3 |
| 30 | 86 | 236 | 7.6 | 5.9 | 473 | 15.2 | 11.8 | 947 | 30.3 | 23.6 |
| 35 | 95 | 218 | 7 | 5.5 | 436 | 14 | 11 | 872 | 27.9 | 22.1 |
| 40 | 104 | 202 | 6.5 | 5.2 | 404 | 12.9 | 10.4 | 808 | 25.9 | 20.8 |
| 45 | 113 | 189 | 6 | 4.9 | 375 | 12 | 9.8 | 751 | 24 | 16.9 |
| 50 | 122 | 177 | 5.6 | 4.6 | 355 | 11.3 | 9.3 | 710 | 22.7 | 18.7 |
Таблица. Растворимость кислорода в соленой (морской) воде. Соленость ~ 35.
|
Давление |
мм рт.ст. |
760 | 1520 | 3040 | ||||||
| 14.7 | 29.3 | 58.7 | ||||||||
|
бары |
1 | 2 | 4 | |||||||
|
кПа |
101.1 | 202.2 | 404.3 | |||||||
|
Температура |
Растворимость |
|||||||||
|
oC |
oF |
μ Моль (микромоль) |
мг/л |
мл/л |
μ Моль (микромоль) |
мг/л |
мг/л |
μ Моль (микромоль) |
мг/л |
мл/л |
| 0 | 32 | 349 | 11.2 | 7.8 | 699 | 22.4 | 15.7 | 1399 | 44.8 | 31.3 |
| 5 | 41 | 308 | 9.9 | 7 | 616 | 19.7 | 14.1 | 1233 | 39 | 28 |
| 10 | 50 | 275 | 8.8 | 6.4 | 550 | 17.6 | 12.8 | 1099 | 35.2 | 25.6 |
| 15 | 59 | 248 | 7.9 | 5.9 | 495 | 15.9 | 11.7 | 991 | 31.7 | 23.4 |
| 20 | 68 | 225 | 7.2 | 5.4 | 450 | 14.4 | 10.8 | 901 | 28.8 | 21.7 |
| 25 | 77 | 206 | 6.6 | 5 | 413 | 13.2 | 10.1 | 826 | 26.4 | 20.2 |
| 30 | 86 | 190 | 6.1 | 4.7 | 381 | 12.2 | 9.5 | 761 | 24.4 | 18.9 |
| 35 | 95 | 176 | 5.6 | 4.5 | 353 | 11.3 | 8.9 | 706 | 22.6 | 17.9 |
| 40 | 104 | 165 | 5.3 | 4.2 | 329 | 10.5 | 8.5 | 658 | 21.1 | 16.9 |
| 45 | 113 | 154 | 4.9 | 4 | 308 | 9.9 | 8 | 616 | 19.7 | 16.1 |
| 50 | 122 | 146 | 4.6 | 3.8 | 292 | 9.4 | 7.7 | 585 | 18.7 | 15.4 |
tehtab.ru
РД 52.24.419-2005 Массовая концентрация растворенного кислорода в водах. Методика выполнения измерений йодометрическим методом
РД 52.24.419-2005
Федеральная
служба по гидрометеорологии и мониторингу
окружающей среды
РУКОВОДЯЩИЙ ДОКУМЕНТ
МАССОВАЯ
КОНЦЕНТРАЦИЯ РАСТВОРЕННОГО
КИСЛОРОДА В ВОДАХ.
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ
ИОДОМЕТРИЧЕСКИМ МЕТОДОМ
Предисловие
1 РАЗРАБОТАН ГУ «Гидрохимический институт»
2 РАЗРАБОТЧИКИ Л.В. Боева, канд. хим. наук, А.А. Назарова, канд. хим. наук
3 УТВЕРЖДЕН Заместителем Руководителя Росгидромета 15.06.2005 г.
4 СВИДЕТЕЛЬСТВО ОБ АТТЕСТАЦИИ МВИ Выдано ГУ «Гидрохимический институт» 30.12.2004 г. № 73.24-2004
5 ЗАРЕГИСТРИРОВАН ГУ ЦКБ ГМП за номером РД 52.24.419-2005 от 30.06.2005 г.
6 ВЗАМЕН РД 52.24.419-95 «Методические указания. Методика выполнения измерений массовой концентрации растворенного кислорода в водах титриметрическим методом»
Главный метролог ГУ ГХИ А.А. Назарова
Введение
Кислородный режим в значительной степени определяет химико-биологическое состояние водных объектов и оказывает глубокое влияние на жизнь водоема.
Источниками поступления кислорода в поверхностные воды являются абсорбция его из атмосферы и продуцирование в результате фотосинтетической деятельности водных организмов. Кислород также поступает в водные объекты с дождевыми и снеговыми водами.
Потребление кислорода обусловлено химическими и биохимическими процессами окисления органических и некоторых неорганических веществ, а также дыханием водных организмов.
Растворенный в воде кислород находится в виде молекул О2. Растворимость его зависит от температуры, давления и минерализации. Растворимость кислорода при нормальном давлении называется нормальной концентрацией.
Насыщение воды кислородом, соответствующее нормальной концентрации принимается равным 100 %. Растворимость кислорода возрастает с уменьшением температуры и минерализации и увеличением давления. Равновесная концентрация растворенного кислорода (мг/дм3) в зависимости от температуры воды приведена в приложении А.
В поверхностных водах концентрация растворенного кислорода может колебаться от 0 до 15 мг/дм3 и подвержена значительным сезонным и суточным колебаниям. В евтрофированных и сильно загрязнённых органическими соединениями водных объектах, а также в конце длительного подледного периода может иметь место значительный дефицит кислорода. Уменьшение концентрации растворённого кислорода до 2 мг/дм3 вызывает массовую гибель рыб и других гидробионтов. ПДК растворенного кислорода для водных объектов рыбохозяйственного назначения составляет в зимний период 4 мг/дм3, в летний — 6 мг/дм3.
Определение кислорода в водах включено во все программы наблюдения и контроля состояния водных объектов.
РД 52.24.419-2005
РУКОВОДЯЩИЙ ДОКУМЕНТ
МАССОВАЯ КОНЦЕНТРАЦИЯ РАСТВОРЕННОГО
КИСЛОРОДА В ВОДАХ.
files.stroyinf.ru
| | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Рабочие среды / / Воздух (Атмосфера) / / Растворимость воздуха в воде. Деаэрация. Закон Генри. Коэффициенты Генри для воздуха. Поделиться:
| ||||||||||||||||||
dpva.ru
Откуда берется кислород в воде? Взаимодействие кислорода с водой. Насыщение воды кислородом
Пожалуй, сейчас даже дети знают, что химическая формула воды — H2O. Однако это теория, а на деле в воде растворено огромное количество веществ как органического, так и неорганического происхождения. Чистая вода, как известно, не имеет вкуса и запаха, но кто угодно может убедиться в том, что в подавляющем большинстве случаев это не так. В питьевой воде, например, содержится некоторое количество минеральных солей, что придает ей солоноватый привкус. В той или иной степени в ней содержится все то, с чем она контактирует. Точный состав воды зависит от места ее забора, ведь в разных местах она контактирует с разными веществами. Кое-где химики найдут в жидкости тяжелые металлы, где-то — различные органические вещества.

Как же так получается?
Вода является универсальным растворителем. Дистилированная вода считается наиболее чистым в химическом смысле веществом, однако через некоторое время она утрачивает свое первоначальное состояние. И вот почему: вода является настолько хорошим растворителем, что со временем в нее попадают молекулы различных веществ из воздуха. В природе же это происходит еще и за счет жизнедеятельности различных организмов, живущих в водной среде.
Газы в воде
Наливая воду в стакан, можно увидеть пузырьки газа, которые будут находиться на стенках сосуда. Наряду с солями и другими веществами вода растворяет в себе и газы. Прежде всего это азот из воздуха, а также кислород, углекислый газ, а в некоторых случаях еще метан и сероводород. Причем холодная вода растворяет газы гораздо лучше, чем теплая, так что чем ниже температура, тем выше концентрация газов. И наоборот — с ростом температуры растворимость падает.
Источники растворенных в воде газов
Но откуда вообще все эти вещества берутся в воде? Азот, как правило, растворяется в процессе взаимодействия с атмосферой, метан — в результате контакта с породами и разложения донного ила, а сероводород образуется как продукт гниения органических остатков. Как правило, сероводород содержится в глубинных водных слоях и не поднимается к поверхности. При его высокой концентрации жизнь невозможна, так, например, в Черном море на глубинах более 150-200 метров из-за высокой насыщенности вод сероводором почти нет живых организмов, кроме некоторых бактерий.
Кислород также всегда содержится в воде. Он является универсальным окислителем, поэтому частично разлагает сероводород, снижая его концентрацию. Но откуда берется кислород в воде? О нем разговор пойдет особый.
Кислород
Практически все живые организмы нуждаются в кислороде. Люди дышат вохдухом, который представляет собой смесь газов, немалую часть которой составляет именно он.
Обитатели водной среды также нуждаются в этом веществе, так что концентрация кислорода в воде — это очень важный показатель. Обычно он составляет до 14 мг/л, если речь идет о природных водах, а иногда даже больше. В той же жидкости, которая течет из-под крана, кислорода содержится гораздо меньше, и это легко объяснить. Водопроводная вода после водозабора проходит через несколько этапов очистки, а растворенный кислород — крайне неустойчивое соединение. В результате газообмена с воздушной средой большая его часть просто улетучивается. Так откуда берется кислород в воде, если не из воздуха?
На самом деле это не совсем правда, из воздуха он тоже берется, но его доля, растворенная в результате контакта с атмосферой, крайне мала. Для того чтобы взаимодействие кислорода с водой было достаточно эффективным, необходимы особые условия: низкая температура, высокое давление и относительно низкая минерализация. Они соблюдаются далеко не всегда, и жизнь вряд ли бы существовала в нынешнем виде, если бы единственным способом образования этого газа в водной среде было взаимодействие с атмосферой. К счастью, есть еще два источника, откуда берется кислород в воде. Во-первых, растворенные молекулы газа в большом количестве содержатся в снеговых и дождевых водах, а во-вторых — и это основной источник — в результате фотосинтеза, осуществляемого водной растительностью и фитопланктоном.
Кстати, несмотря на то, что молекула воды содержит кислород, извлечь его оттуда живые организмы, конечно, не в состоянии. Поэтому им остается довольствоваться именно растворенной долей.
О значении водорослей
Мало кто в обычной жизни задумывается, чем мы дышим и почему состав воздуха именно такой, какой он есть. Практически все знают, что большинство живых организмов, дышащих воздухом, приспособлено именно к такой смеси. Но если речь идет о наземно-воздушной среде, то вопросов не возникает. А откуда в воде кислород? Как и на земле, там много растений, которые с помощью процесса, который называют фотосинтезом, потребляя свет и углекислый газ, выделяют O2.
Если же быть точнее, в последние десятилетия по тем или иным причинам человечество уничтожило огромную часть лесов. Но речи о глобальном кризисе пока нет, хотя население планеты постоянно растет, и потребление кислорода
огромно. И огромное значение в этом вопросе имеют водоросли, которые обитают в Мировом океане, большей частью именно за их счет происходит насыщение воды кислородом. Некоторые их виды люди и морские обитатели употребляют в пищу, но их количество остается достаточным для эффективного фотосинтезирования. Вот откуда берется кислород в воде, а значит, благодаря газообмену с атмосферой, и в воздухе. Именно фотосинтез водорослей — его основной источник. Кстати, именно за счет процессов, происходящих в растениях, был накоплен первичный кислород в атмосфере, а сейчас происходит только поддержание ее неизменного состава.
Роль растворенного кислорода (РК)
Несмотря на то что дыхательная система водных обитателей устроена иначе, чем у жителей наземно-воздушной среды, они нуждаются все в тех же веществах. Прежде всего речь идет о кислороде, который играет важную роль в жизнедеятельности подавляющего большинства организмов. И если мы извлекаем его из атмосферы, где его доля более или менее стабильна и составляет около 21%, то жители рек, морей и океанов сильно зависят от того, сколько кислорода в воде содержится в месте их обитания. Помимо рыб, кислород нужен и растениям. Однако его продукция обычно выше, чем уровень потребления, так что это не должно вызывать беспокойства.

Нормальные показатели
Из-за своей значительной роли в нормальном функционировании экосистем, уровень РК часто подвергается контролю со стороны биологов и экологов. Ведь в природе все связано, нарушение газового баланса в одном водоеме может вызвать проблемы и в соседних, если они связаны. Как правило, замеры проводятся до полудня, в этот период концентрация газа в поверхностных водах становится максимальной и составляет до 14 мг/л. Этот показатель подвержен серьезным суточным и сезонным колебаниям, но он не должен опускаться ниже 4 мг/л.
Уменьшение концентрации до 2 мг/л и менее вызывает массовую гибель обитателей гидросферы. Фактически — от удушья. Постепенное снижение показателя может говорить о загрязнении водоема и также может со временем закончиться гибелью водных жителей.
РК в искусственно созданных экосистемах
Важное значение хорошая аэрация имеет, например, в аквариумистике. Именно поэтому необходимо не только устанавливать специальные насосы, закачивающие воздух в воду и насыщающие его кислородом, но и, например, при необходимости высаживать на дне различные водоросли. Конечно, тем, кто имеет подобное хобби, в первую очередь интересна эстетика экосистемы, однако нельзя забывать о ее устойчивости и некой долговечности.
Если же речь идет о рыбных хозяйствах, производстве жемчуга и других специфических отраслях подобного типа, то помимо различных мер, направленных на сохранение достаточной концентрации растворенного кислорода в воде, необходимо регулярно проводить измерение этого показателя с помощью специальных проб. При их заборе крайне важно, чтобы не произошло контакта с воздухом, это может исказить результаты анализа.
fb.ru
